時間:

作者:陳天伊、庾莉菊、寧保明等
通過對國內外文獻進行調研,探討往復架溶出度測定方法的研究進展和應用現狀。往復架法可根據劑型選擇樣品架,能夠更好地滿足透皮貼劑、緩釋制劑、眼用植入劑、陰道環制劑、藥物涂層支架等多種特殊劑型或藥械組合產品的研發和質量控制需求,有著廣闊的應用前景,為相關制劑開展體內外相關性的研究提供有益的技術支持。

往復架法溶出度儀( reciprocating holder dissolu- tion apparatus) 的工作原理與往復筒法溶出度儀工作原理相似,這2種溶出儀器不僅可共享同一操作平臺,而且都可方便地更換不同pH的溶出介質。往復架法溶出度儀被廣泛應用于透皮貼劑、緩釋制劑、植入劑、陰道環制劑、藥物涂層支架等多種劑型和藥械組合產品的溶出度研究。截止至2022年,僅USP通則<724 >中收載了往復架法。國內外藥典溶出方法的最新收載情況見表1 。
往復架法的研究歷史可追溯至20世紀70年代,國內對其的研究尚處在起步階段。目前國內已有數十家機構和企業正采用往復架法開展藥物制劑的溶出或釋放研究。本文將對往復架法的發展背景、裝置組成和工作原理、主要特點及其在藥物制劑中的應用進行綜述,并對往復架法的未來應用進行探討。
往復架法最早是為了適應透皮貼劑質量控制的需求而發展起來的溶出度方法。1968年Alejandro Zaffaroni博士創立了ALZA公司,該公司的業務主要集中在透皮貼劑、滲透泵制劑、脂質體和植入劑等 的研發。其中,透皮貼劑又稱經皮給藥制劑,透皮貼劑可有效避免肝臟首過效應,還可以實現緩釋給 藥,因此在臨床上成為了一些疾病治療的首選劑型。1969年,Zaffaroni博士申請了第1個通過皮膚或者口腔黏膜吸收的可作用于全身的藥物緩釋膠布技術專利后,陸續有越來越多的透皮制劑申請專利并批準上市 。1979年12月,由ALZA公司研發的現代醫學意義上的第1款透皮貼劑東莨菪堿透皮貼劑(Transderm Scop ? )由美國食品藥品監督管理局(FDA) 正式批準上市。隨后該公司陸續研發上市了用于治療心絞痛的硝酸甘油透皮吸收貼劑 (Transderm-Nitro ? ) ,用于補充雌激素的雌性激素 透皮貼劑(Estrogen ? ) ,用于止痛的芬太尼透皮貼劑(Duragesic ? ) ,用于輔助戒煙的尼古丁透皮貼劑 (Nicoderm ? ) 等。1974年為滿足透皮貼劑質量控制的需求,ALZA公司設計制造了第1臺擁有手動操作系統的采用往復碟為樣品架的ALZA溶出度儀,又稱往復碟法溶出度儀(reciprocating disk dissolution ap- paratus),即為往復架法溶出度儀的雛形。
隨著透皮貼劑制劑技術的不斷進步,單一的往復碟樣品架已經不能滿足研發和質控的需求。于1990年獲批上市的儲庫型芬太尼透皮貼劑,最小規 格制劑的釋藥面積較大,為10cm2,且不宜剪裁,故不適用于表面積較小的往復碟,為滿足試驗需要,選用了圓筒貼劑專用樣品架。
FDA 要求新型制劑質量控制所用的儀器須是商業化的裝置,所以ALZA公司后與Vankel 公司合作開發出了往復架法商用溶出儀,該裝置于1990年被 USP收載為藥典標準溶出裝置,命名為往復碟法。1995年往復碟法正式更名為往復架法,并收載了用于透皮貼劑、滲透泵型緩釋片等用于多種不同類型制劑的專用樣品架。
滲透泵型緩釋制劑也可采用往復架法進行體外溶出度的測試。1955年 Rose S 和 Nelson J 設計了首個基于滲透壓的連續給藥裝置,滲透泵制劑的概念也首次被提出。緩控釋制劑,被認為是目前最為理想一種口服制劑,也越來越受到藥物制劑工作者的青睞。1972年Theeuwes等共同研發了初級滲透泵專利,Theeuwes于1975年采用往復架法裝置對氯化鉀滲透泵片的體外溶出行為進行了考察。1982年全球第1款滲透泵型緩釋片吲哚美辛片成功在美國和英國上市,隨后陸續有多個品種的滲透泵型制劑獲批上市。1989年硝苯地平緩釋片在美國上市,FDA 溶出度數據庫公開信息表明該品種采用了往復架法進行溶出度試驗。
隨著制劑技術的發展,往復架法應用的制劑類型越來越具有多樣性。2003年4月全球第1款藥物涂層支架西羅莫司涂層支架在歐洲上市,同年,Varian公司開始著手研制用于藥物涂層支架類藥物的改進型往復架法溶出裝置。改進型往復架法溶出裝置于2007年4月正式投入市場,為醫療器械類產品的釋放速率測試提供了新思路 。1958年在美國首次獲批的醋酸地塞米松眼用植入劑,在 2010 年的上市審評報告中采用了往復架法進行藥物的體外溶出測試。
1998年ALZA公司的芬太尼透皮貼劑首次在中國注冊,中國食品藥品檢定研究院也引進了國內第1臺可采用透皮貼劑專用圓筒的往復架法裝置,開始了往復架法的相關溶出試驗。2019 年以來,國內有多個儀器公司實現了往復架溶出度儀的國產化,有助于擴大該方法在藥物研發、審評和監管中的應用。包括制藥企業、科研院所以及藥檢機構在內,國內有往復架法溶出度儀的實驗室共計50余家。2021年我國國家藥典委員會將往復架法的建立和研究,列入藥品標準提高計劃,為《中華人民共和國藥典》通則<0931>溶出度與釋放度測定法中增訂該方法進行專項研究。
往復架法裝置由溶出杯、電動機、垂直往復移動樣品的往復軸和支架、恒溫水浴或其他適當的溫控系統組成。
采用往復架法溶出度儀進行試驗時,可根據待測樣品的劑型特點和藥物釋放特點選擇適宜規格的樣品架和適當體積的溶出杯,將樣品進行固定后,在溶出工作站軟件按照試驗要求設置溫度、往復頻率、振幅及規定樣品自動運行到新一排溶出杯繼續溶出試驗的時間間隔等試驗參數。目前,相關藥典暫未對取樣位置和取樣體積進行明確的規定,用戶可根據需要來確定。溶出工作站軟件還可以結合取樣工作站對往復架法溶出度儀進行控制和事件記錄。由此來完成待測樣品采用往復架法溶出度儀的完整體外釋放過程。
儀器一般為六排七列,各排之間互不干擾,每排可根據試驗條件選擇不同的溶出介質,即在試驗過程中可以使用至少6種溶出介質,如果程序設計適當,也可在第6種溶出介質溶出結束后,回到初始或適當的位置,在新的溶出杯或介質中繼續試驗。
往復架法溶出度儀的溶出杯為平底管狀容器,一般由玻璃或其他的惰性材料制成,也可根據試驗的具體需要選擇其他適當的材料。根據不同品種制劑的試驗要求可選用3~1 000mL不同規格的溶出杯。對于一些試驗時間較長的劑型,則推薦使用帶刻度的溶出杯,方便溶出介質揮發后進行補液,并建議使用防蒸發蓋。
在試驗過程中,溶出杯浸沒于適宜溫度的水浴中,試驗溫度可選擇范圍為 5~55 ℃ 。用于透皮貼劑時,溶出介質的溫度為(32±0. 5) ℃ , 用于其他劑型時溶出介質溫度一般為(37± 0.5) ℃ 。
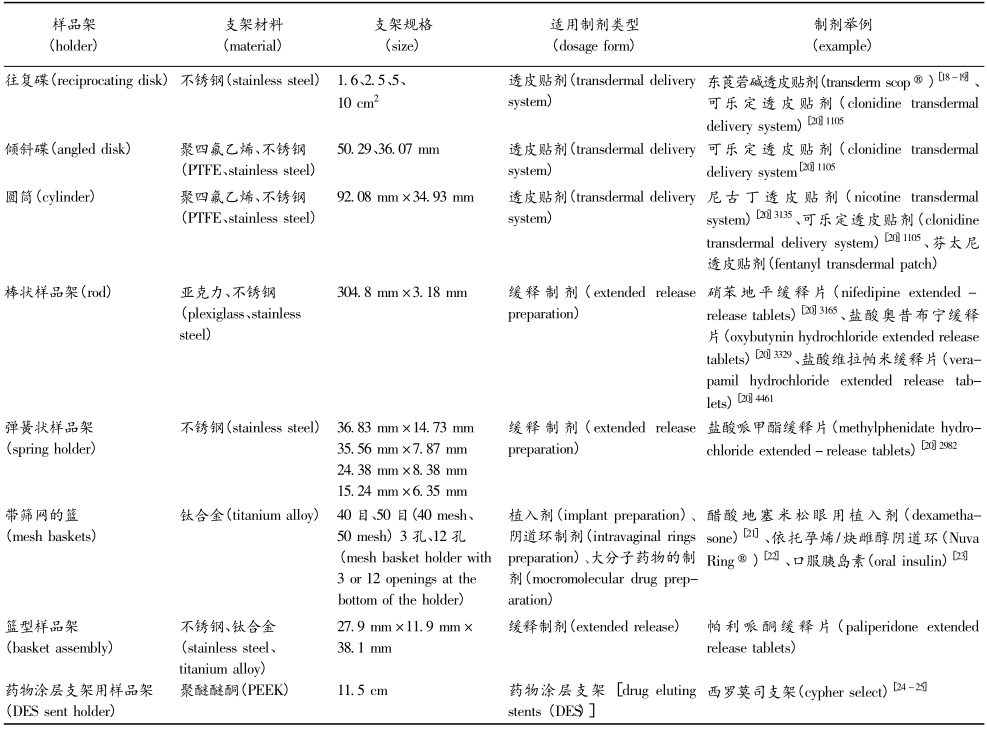
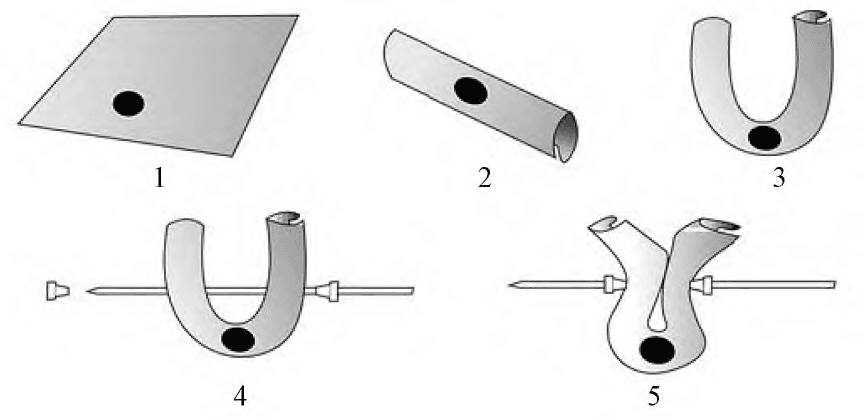
往復架的各項參數除另有規定外,往復頻率約為30dip·min-1,振幅約為2cm 。在 USP中往復架法收載有多種不同的樣品架。不同類型和尺寸的樣品架適用于不同形狀的劑型和不同用途的產品,如透皮貼劑、滲透泵片、植入劑、藥物涂層支架、微球、微囊、脂質體、納米粒等,試驗時可根據具體的樣品選擇相應的樣品架,然后將其固定并在介質中以一定頻率做上下往復運動。不同樣品架的示意圖見圖1,樣品架的相關尺寸、材料信息和應用情況詳見表2 。
4.1 可模擬體內環境
與籃法、槳法溶出度儀相比,往復架法溶出度儀 通過控制溫度、往復架運動頻率等物理參數,獲得了更為劇烈的剪切力,以達到和體內動態環境相似的生物學相關條件,可滿足透皮貼劑、口服緩釋制劑、植入劑等對溶出試驗條件的需求。
藥物口服進入體內后,在復雜的胃腸道生理環 境中逐漸發揮藥效,往復架法溶出度儀的突出優點之一,即可以幾乎不受限制的改變溶出介質,對于一些需要考察一系列pH 梯度或不同溶出介質對藥物釋放度影響的制劑有著一定優勢。
4.2 可靈活選擇樣品架
與往復筒法、槳碟法與轉筒法相比,往復架法更適用于透皮貼劑、植入劑、藥物涂層支架等特殊制劑的原因在于往復架法根據制劑種類、規格等不同分別開發了不同的樣品架,可在試驗設計中根據試驗的具體需求進行選擇。在一定程度上,往復架法可以實現往復筒法、槳碟法、轉筒法裝置的功能。
 A.往復碟 B.傾斜碟 C.圓筒 D.棒狀樣品架 E.彈簧狀樣品架 F.籃型樣品架 G.帶篩網的籃 H.藥物涂層支架用樣品架
A.往復碟 B.傾斜碟 C.圓筒 D.棒狀樣品架 E.彈簧狀樣品架 F.籃型樣品架 G.帶篩網的籃 H.藥物涂層支架用樣品架
Mazzo 等研究表明,使用槳碟法與往復架法2種溶出方法分別進行溶出試驗,得到的藥物釋放曲 線是相似的,但是往復架法得到的溶出曲線的平均相對標準偏差更小。對透皮貼劑類藥物進行體外釋放度的評價,往復架法具有儀器成本低,操作簡單等優點,且往復架法溶出儀器具有良好的數據重復性。
一些貼劑因為貼片的特殊設計,幾何形狀和尺寸等并不適合采用槳碟法進行試驗。例如面積較大的貼片,槳碟法因其樣品盤面積固定且有限,就無法完成體外溶出檢測,對于這樣的產品,此時往復架法 溶出度儀中的圓筒樣品架就成為了首選。
4.3 適用于低劑量化合物
往復架法溶出度儀可以根據受試制劑的具體情況,靈活地選擇5、10、20、50、100、300、1 000mL的溶出杯。一些植入劑、藥物涂層支架等載藥量低且藥物溶解度也低的新型制劑,體外釋放試驗復雜,且釋藥周期 往往需要數周甚至數月。此時可以選擇往復架法采用較小溶出介質體積,并選擇有密封蓋等密封性好的裝置進行試驗,可以顯著提高檢測的靈敏度,并且最高限度地減少溶出介質的揮發。往復架法為這類載藥量低及釋藥周期長的藥物的釋放試驗提供了思路。
目前,USP和FDA溶出度數據庫等公開的藥物體外釋放度測定方法中,往復架法主要應用于透皮 貼劑、緩釋制劑和植入劑。在USP中有7個品種采 用往復架法進行釋放度檢查,分別是可樂定透皮貼劑、鹽酸哌甲酯緩釋片、尼古丁透皮貼劑、硝苯地平緩釋片、鹽酸奧昔布平緩釋片、鹽酸偽麻黃堿緩釋片和鹽酸維拉帕米緩釋片( 見表3) 。FDA 溶出度數據 庫中有4個品種采用往復架法進行釋放度檢查,分別為醋酸地塞米松眼用植入劑、芬太尼透皮貼劑、鹽酸氫嗎啡酮緩釋片和東莨菪堿透皮貼劑(見表4 ) 。文獻報道的研究中,往復架法的應用亦主要集中在 透皮貼劑和緩釋制劑中,并不斷往眼部植入劑、大分子藥物的制劑、陰道環制劑、藥物涂層支架等其他特殊藥物制劑及藥械組合產品中拓展。
5.1 透皮貼劑
透皮貼劑在進行體外溶出試驗時,常在擴散池中進行,為了實現更好的質量控制,使試驗操作更為 經濟便捷,透皮貼劑的溶出還可以通過往復筒法、槳碟法、轉筒法等方法進行試驗,在USP和FDA溶出數據庫中收載的透皮貼劑中還采用了往復架法,為透皮貼劑溶出度測定提供了更多選擇。
在采用往復架法開展透皮貼劑的溶出度試驗時,一般將透皮貼劑固定于往復碟、傾斜碟或圓筒(圖1-A、B、C) 等專用于透皮貼劑的樣品架上,釋藥面朝外。對儀器裝置進行往復運動的振幅、往復頻率、浸出時間和保持時間等試驗參數的設置,以實現體外釋放的試驗目的。
東莨菪堿透皮貼劑是一種圓形扁平狀貼片,應用于頭部或耳后完整的皮膚區域,實現東莨菪堿連續釋放的目的,用于預防與暈車有關的惡心、嘔吐,以及麻醉和手術中的恢復。Mazzo 等分別采用往復架法、槳碟法和擴散池法 3 種溶出裝置對東莨 菪堿透皮貼劑開展了體外溶出研究。試驗選擇了往復碟(圖1-A) 作為樣品架,試驗結果表明,以上3種方法在72h內的東莨菪堿釋藥量大致相同,其中往復架法與擴散池法單位時間內東莨菪堿釋藥量幾乎相同,槳碟法24h的初始釋藥量明顯較為緩慢,往復架法與槳碟法2種溶出方法所獲得的藥物釋放曲線是相當的 ; 往復架法、槳碟法和擴散池法3種溶出 方法的平均相對標準偏差分別為4. 6% 、5. 4% 和6. 7% ,即往復架法的變異性與其他2種方法相比較小,更適用于透皮貼劑這一類型制劑的體外溶出度試驗。但是在試驗過程中往復架法與槳碟法需采用 透析膜將制劑與支架進行固定,這時就需證實透析膜是否會改變制劑的釋放速率,且往復架法與槳碟法都需將東莨菪堿透皮貼劑完全浸泡,因此如果制 劑邊緣未完全密封,會造成制劑不受控制的從邊緣擴散的情況。東莨菪堿透皮貼劑作為全球首款透皮吸收制劑就采用了往復架法進行體外溶出質量控制,體現出了往復架法在透皮貼劑中應用的優勢。
Zhou等分別采用VanKel/Varian公司生產的 往復架儀器和Logan公司生產的RRT-7往復架儀器對東莨菪堿透皮貼劑進行釋藥考察,試驗條件為選用20mL的水作為溶出介質,溫度為(32. 0 ± 0. 3) ℃ , 以往復碟( 圖 1 -A) 作為樣品架,振幅為2~3 cm,往復頻率為45dip·min-1。試驗結果表明,2種儀器得到了相似的釋藥溶出曲線,表明不同廠商生產的往復架具有一定的重復性。
可樂定是可用于各型高血壓的中樞性強效降壓藥。可樂定的有效濃度極低,在4. 63~9. 26 nmol · L-1濃度范圍內,即可產生降壓藥效,如血藥濃度過高,可能會引起血壓上升等不良反應,故其應用受到限制,而透皮貼劑的劑型特點為解決這一問題提供了思路 。USP中收載的可樂定透皮貼劑藥品標準有4種體外溶出試驗測定法1105,其中2種方法是往復架法。標準中除規定了試驗溫度為 ( 32. 0±0. 3) ℃ , 往復頻率為30dip ·min-1 外,還根據制劑規格的不同、釋藥面大小區別,分別提供了往復碟、 傾斜碟和圓筒( 圖 1 -A、B、C) 3 種樣品架,并選用80mL或200mL的0. 001 mol·L-1磷酸溶液作為溶出介質。同時USP中還規定在試驗完成后,將溶出杯取出烘干杯外水浴水后稱量,以計算蒸發量。
尼古丁,又稱為煙堿,是煙草具有成癮性的主要原因。目前尼古丁透皮貼劑常作為一種戒煙的輔助劑,其作用已經在多年臨床應用中得到了廣泛的驗證 。USP 收載的尼古丁透皮貼劑藥品標準有4種體外溶出試驗測定法3153 ,涉及槳碟法、往復架法和轉筒法3種儀器,其中第一法是往復架法。具體要求參數為將尼古丁透皮貼劑置于10cm×10cm高分子透析膜中心,將粘合劑側貼在膜上。用2個O型圈將薄膜固定在圓筒(圖1-C)上,使透皮系統的1個邊緣與凹槽對齊,纏繞在圓筒上。介質為250mL的水,溫度為(32. 0 ± 0. 3) ℃ 。往復頻率為30 dip·min-1,振幅為(2. 0±0. 1) cm 。分別在2、12和24h,將樣品架轉移至新的介質中繼續溶出直至試驗結 束。且在每個取樣時間點結束時,將溶出杯放冷后通過加水彌補蒸發損失。Li 等采用槳碟法和往復架法對尼古丁透皮貼劑的體外藥物釋放進行了比較,在槳碟法中溶出介質體積為 200mL,轉速為50r·min-1,槳葉與圓盤的距離為(25 ± 2 ) mm ; 在往復架法中溶出介質體積為20mL,選用了往復碟( 圖1-A)為樣品架,采用了2-氰基丙烯酸酯膠對貼劑與樣品架進行固定,往復頻率為30dip·min-1,振幅為(2. 0 ± 0. 1) cm。試驗選用了pH 7. 4的PBS緩沖溶液,試驗溫度為(32. 0 ± 0. 5 ) ℃ 。試驗結果 表明2種溶出方法的溶出曲線相似,往復架法的RSD( 0. 4%~ 3. 1% ) 小于槳碟法的RSD ( 2. 4% ~ 7. 1% ) ; 試驗人員同時還在不同日期進行了往復架法的試驗以驗證方法的重復性,結果表明2次試驗的藥物釋放的差異由藥物內部的差異產生,重復性符合要求。該研究顯示,往復架法的溶出結果數據變異性小,且具有操作更為簡單及使用溶出介質體 積小的優點。對于大型透皮貼劑系統而言,往復架法可更換各種樣品架以適應不同規格的透皮貼劑,而槳碟法因其樣品盤面積固定在具體應用中受到了一定限制。
5.2 緩釋制劑
緩釋制劑是指能在長時間內持續釋放有效成分以達到長效作用的制劑,這種制劑的優點在于可在較長的時間內維持平穩的血藥濃度,減少了藥物濃度“峰谷”的出現,與普通制劑相比顯著減少了患者 的用藥次數,并且因其獨特的釋藥機制,緩控釋制劑 可以實現藥物釋放的定時、定位、定速,從而使藥物發揮出了更大的療效,進而成為了近幾年臨床上研究的熱點。
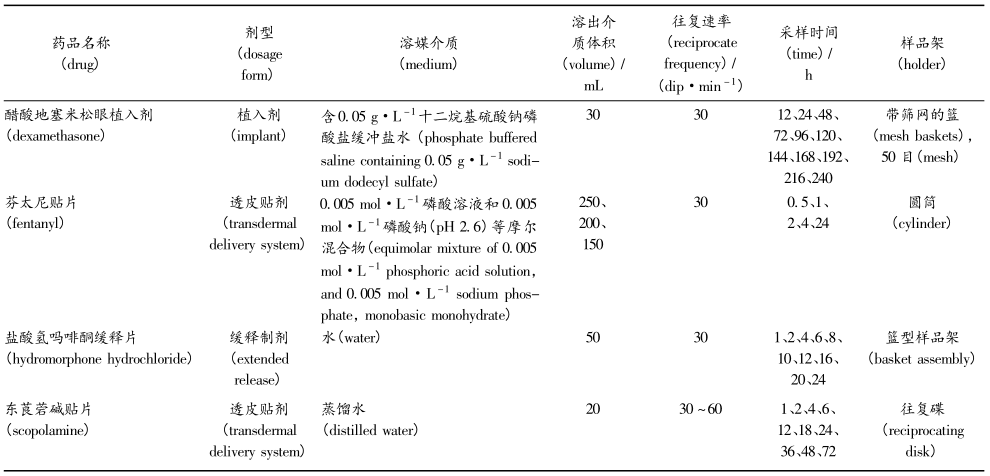
在USP中收載了采用棒狀樣品架(圖1-D) 的鹽酸奧西布平緩釋片、硝苯地平緩釋片、鹽酸偽麻黃堿緩釋片和鹽酸維拉帕米緩釋片,其中鹽酸偽麻黃 堿緩釋片采用的棒狀支架較為特殊( 見圖2) 972,將制劑放置包裹于尼龍網中心后,使用棒狀支架,穿過并固定尼龍網。鹽酸哌甲酯緩釋片采用了彈簧狀支架( 圖1-E) 。FDA溶出度數據庫中鹽酸氫嗎啡 酮緩釋片推薦使用籃型支架(圖1-F) 進行試驗。緩釋制劑最常用的體外溶出試驗方法是籃法和槳法,在USP中90%以上的品種選用了上述2種方法,但這2 種方法在實際應用中存在一些問題,比如部分緩釋制劑采用槳法時極易黏壁,采用籃法時易黏連在金屬籃上影響其釋放,導致方法的重現性較差,且區分效果不理想。當采用往復架法的棒狀支架后,樣品固定于棒狀支架尖端,有效避免了黏連問題,提高了方法的重現性。
1.片劑置于 5cm × 5cm 尼龍網
2.尼龍網折疊包裹片劑
3.片劑居中,尼龍網兩開口端對折
4.棒狀支架,穿過并固定尼龍網
5.采用適當配件固定尼龍網
采用往復架法進行緩釋制劑體外溶出研究的相關文獻報道主要集中在滲透泵型緩釋制劑和緩釋微丸。1975 年,Theeuwes的報告中選用往復架法對滲透泵型緩釋片氯化鉀滲透泵片的體外溶出進行了考察,試驗中并沒有明確說明選用了往復架法溶出 裝置,但是在對試驗參數的具體描述時,比如定時將 系統從1個溶出杯移動到下1個溶出杯,并測定每個溶出杯中制劑的釋放量,且要求往復頻率為30dip · min -1 ,振幅為2. 5cm等都可看出該研究使用了往復架法。試驗結果表明往復架法得到的體外溶出數據與狗胃腸道中的體內試驗數據體內外相關性良好,表明往復架法適用于滲透泵型緩釋制劑的體內外相關性研究。
緩釋微丸是由藥物與阻滯劑混合成丸或在普通丸芯基礎上包裹控釋衣膜的小型丸劑 。緩釋微丸的涂層厚度顯著影響著藥物的釋放速度,因此,開發可以準確評價微丸涂層厚度的方法很有必要。Xu等采用往復架法對單個微丸顆粒體外溶出進行評價,試驗人員采用三因素三水平的 Box-Behnken 響應面法對往復頻率、取樣間隔和溶出介質體積進行了考察,采用了方差分析和響應面分析確定了設計變量之間的主要影響和交互影響,最終確定了試驗條件為在 ( 37. 0 ± 0. 5 ) ℃ , 往 復 頻 率 為 30 dip · min-1 ,溶出介質體積為6mL,取樣間隔40min的試驗條件。通過上述確認的試驗方法與采用籃法和槳法的藥物從顆粒團中的釋放結果進行比較,試驗結果表明,籃法和槳法得到的顆粒團的釋放曲線變異性較大,主要原因是顆粒間的聚集; 采用往復架法對單個顆粒進行試驗時發現得到了累計釋放呈線性的曲線,并可以很好地區分不同包被量的微丸。
5.3 其他特殊藥物制劑
一些低劑量的緩釋劑型的藥物釋放試驗需要精確化、標準化的方法。目前很多新興的劑型比如陰道環制劑、眼用植入劑、血管支架、關節腔內混懸液、大分子多肽類藥物等在體外溶出試驗中都普遍存在著溶劑量低,釋藥時間長,加速試驗溫度較高等的問 題,應用往復架可在一定程度上解決上述問題。
5.3.1 眼部植入劑
眼部植入劑( ocular implant) , 系指將藥物與輔料混合制成條狀或小塊狀的由手術植入眼部的無菌固體制劑,從而使得藥物緩慢、平穩、持續的釋放,其釋藥時間可長達數月至數年,多用于治療眼后部感染等疾病。但是,因其給藥時間間隔一般在1~2個月,時間較長,結果導致體內藥物濃度難以控制,經常低于治療濃度,因此眼部植入劑的體外釋放方法的開發很有必要。在USP中流池法、往復架法和搖瓶法均是玻璃體內植入劑溶出測試的推薦方法 。這 3種溶出方法方便采用較小的溶出介質體積以實現較小載藥量的植入劑的溶出所需的條件。
以醋酸地塞米松眼用植入劑為例,地塞米松是糖皮質激素,具有優越的抗炎和免疫抑制作用,醋酸地塞米松眼用植入劑是由 Allergan 公司研發的玻璃體植入劑,外觀呈棒狀,用于治療白內障摘除并植入人工晶體后的術后眼內炎癥,最早于1958年在美國上市。根據FDA 溶出數據庫,醋酸地塞米松眼用植入劑體外釋放選用了50目帶篩網的籃作為樣品架( 圖1-G) ,以 0. 05 g·L-1 的十二烷基硫酸鈉緩沖液30 mL 作為溶出介質,在(45 ± 0. 5) ℃ 的溫度下以30 dip·min-1的往復頻率進行溶出試驗,試驗過程持續240h 。FDA建議,眼用植入劑可選在45℃ 的溫度下進行高溫溶出試驗,以加速藥物的釋放行為。FDA 推薦的試驗方法有溫度較高和持續時間較長2個特性,所以如果采用普通的往復架儀器進行試驗,將會面臨溶出介質蒸發對試驗結果造成的影響,因此可使用帶有刻度的溶出杯并定期對蒸發掉的溶出介質進行補液,也可選用密封性更好的裝置進行試驗。
Sandra 等分別采用往復架法和搖瓶法對醋酸地塞米松眼用植入劑的體外釋放度進行了考察,其中往復架法選用 pH 7. 4 的緩沖溶液在37 ℃ 的條件下用3孔和12孔的帶篩網的籃 ( 圖1-G ) 以20 dip·min-1 的頻率進行溶出試驗,試驗表現出較高的變異性,可為臨床觀察到的高變異性提供支持,各植入劑的差異可能是由制劑間不同的崩解行為導致的,試驗結果同時表明3孔的金屬籃 (7. 6%±1. 2% ) 平均釋藥率高于12孔金屬 籃 (4. 4% ±2. 5% ) 的平均釋藥率,在試驗的前9d 時間里,2種支架的釋藥量是相當的,約在 0. 5% ± 0. 03% 。往復架法與搖瓶法相比可通過更換樣品架。介質體積、往復頻率等改變測試條件。例如較低的往復頻率,可以為植入劑提供較緩和的流體動力學環境,避免植入劑在較大機械應力的條件下造成的制劑破裂導致藥品的突釋。
目前很少有在生物條件下眼內植入劑的藥物釋 放的相關研究,在模擬玻璃體的生理條件時,其獨特的特性如其凝膠狀結構等總是被忽略,使得藥物的體外釋放數據與體內的實際生理情況不等效問題 出現。Tobias等針對玻璃體內植入劑開發了仿玻璃體生理環境的體外溶出模型,并分別通過USP收載的流池法和往復架法與其開發的體外溶出模型進 行比較。在試驗中往復架法選用了12孔的帶篩網 的籃( 圖1-G) 作為樣品架,以 30dip·min-1的往復 頻率在10mL pH7. 4的溶出介質中試驗,結果表明,流池法中35min后和往復架法中150min 后,含曲安奈德的普通植入劑藥物釋放完成,而在新的體外溶出模型中96h后藥物才實現完全的釋放,這些結果表明這種新型體外溶出模型與USP溶出方法相比藥物釋放速率明顯更慢,即USP可能存在高估了植入劑在玻璃體內的釋放速率的問題。綜上建立具有玻 璃體生理相關條件的體外釋放方法是非常有必要的,這也是往復架法的改進方向之一。
5.3.2 大分子藥物的制劑
多肽等大分子藥物的 制劑在胃腸道中降解且經黏膜的滲透較低,因此設計口服給藥劑型極具挑戰,是研發口服大分子類藥物必然要面臨的問題。在現階段研究中提出了使用彈性材料( elastomeric material) 的口服給藥裝置的概 念,這種裝置具有增加胰島素等肽類分子吸收的 潛力。
在體外溶出試驗中為了驗證彈性材料是否完全展開,并得到遞送裝置的胰島素釋放曲線,以此證實在胃的pH下的胰島素是否得到了保護作用,試驗人員選擇了可以隨時自由更換溶出介質的往復架法進行試驗驗證。
J?rgensen等采用往復架法對胰島素的體外釋放進行了研究,以pH為 4. 0的50 mmol·L-1的檸檬酸鹽緩沖液和pH為7. 0的50mmol·L-1磷酸鹽緩沖液為釋放介質,將口服給藥裝置置于50目帶篩網的籃( 圖 1-G) 中,在5mL溶出杯中,以15dip · min -1的頻率在pH 4. 0 的溶出介質中溶解1h,以考察制劑的耐酸性,后在pH 7. 0的溶出介質中溶解5h,分別在10、30、60、70、80、90、105、120、150、180、240和360min定時自動取樣0. 5 mL,每次取樣完成后每個溶出杯內介質都用新鮮的溶出介質替換。試驗結果表明,即使在相對酸性較大的胃酸條件下,彈性材料也起到了很好的保護作用。當介質更換為pH7. 0的介質時,胰島素開始釋放,持續釋放時間約為2~3 h 。這一體外釋放度試驗充分體現出了往復 架法可方便并及時更換介質的優越性。
5. 3. 3 陰道環制劑
陰道環( intravaginal rings) 是20世紀70 年代初發展起來的新型藥械組合產品,是非常有前途的全身給藥的方式。陰道環制劑是緩釋給藥系統中的1種,即將藥物置于無活性的載體中,藥物通過載體的微孔向體內擴散,以恒定速率釋放 最低有效劑量的藥物。隨后藥物經陰道上皮黏膜吸收,直接進入血循環,避免了肝腸的首過效應,并維持血藥濃度的相對穩定,達到長效作用的目的,尤其適用于一些低劑量的例如炔雌醇等固醇類化合物。
1969年,Duncan申請了第1個用于雌性哺乳動物陰道內的環形給藥裝置,但直到20世紀90年代初,第1款孕酮陰道環( Progering ? )才被批準上市,在此后不久 Femring ? 和 Estring ?陸續上市。2002年第1個由依托孕烯/ 炔雌醇聯合避孕的陰道環制 劑 NuvaRing ? 被 FDA 批準上市。目前,市場上有幾種用于激素替代療法或避孕的長效類固醇釋放陰道環制劑可供選擇。
目前尚無針對陰道環制劑的標準藥物釋放方法。常用于陰道環制劑的藥物測試方式通常在培養箱搖瓶( incubative shaking in stoppered flasks) 中進行,以水和緩沖溶液作為溶出介質 。Externbrink 等采用往復架法對NuvaRing ? 進行溶出度的體外研究,試驗選用了50目帶篩網的籃( 圖1-G) 作為樣品架,分別選用37℃下10mL的模擬體液 (VFS) 和水作為溶出介質,介質每12h 更換1次,結果表明2種溶出介質的試驗結果相當,即水中的平衡溶解度為(6. 46 ± 0. 23) μg·mL-1,模擬體液中的平衡溶解度為(6. 04 ± 0. 24) μg·mL-1,其體外溶出曲線具有一致性。同時試驗人員還分別在44、50 和 55 ℃ 的條件下用模擬溶出介質進行了高溫加速試驗,在37、44、50和55 ℃溫度下的零級釋放常數分別 為 97. 4、207. 2、440. 3、738. 5 μg·d-1,符合在高溫條件下溶出速率會增加的猜想,當試驗溫度從37 ℃ 升到 55 ℃ 時,體外釋放的評價效率提高了7倍以上,驗證了加速試驗的有效性。
5. 3. 4 藥物涂層支架
藥物涂層支架(DES) 是利用裸金屬支架平臺攜帶( 載) 抗血管內膜增生的藥物, 在血管局部洗脫釋放,有效抑制支架內膜增生,以預防支架內再狹窄的支架。藥物涂層支架包括以不銹鋼或鈷-鉻制成的裸支架,這些支架被帶有抗增生作用的藥物載體所覆蓋,其聚合物載藥涂層包括永久、可降解和無聚合物載藥涂層等技術。所載藥物包括利莫司類和紫杉醇等 。這一類藥物的體內研究一般都集中在血液中的藥物水平,而不是藥物在靶部位的血藥濃度,藥物在組織中的濃度目前一般是在移除支架后的動物模型中進行確認,試驗過程較為繁瑣復雜,因此,開展體外研究對藥物涂層支架的釋放行為研究非常有幫助。洗脫支架類藥物在臨 床上得到了非常廣泛的應用,但是在體外釋放行為研究中只有少數的幾種體外釋放裝置可供選擇。這類藥物體外釋放研究的難點在于載藥量 ( 通常在50~350 μg) 和溶解度較低,血藥濃度低不利于測定 ; 體外釋放試驗復雜 ; 釋藥周期較長 ; 試驗方案、裝置的選擇存在著很多問題。
20世紀70年代中期科學家發現了天然的具有 抑制細菌增殖作用的抗生素——— 西羅莫司(也被稱為雷帕霉素) 。2002 年和 2003 年含有藥物西羅莫司 的藥物裝置組合產品分別在歐洲和美國獲批上市, 這是市場上最早的藥物涂層支架。Seidlitz 等采用流池法、改進流池法( vessel-simulating flow-through cell,VFTC) 和往復架法等多種裝置對西 羅莫司藥物涂層支架的釋放特性進行了比較研究。其中往復架法的溶出試驗方法是將藥物固定于樣品架上置于帶有密封圈的10mL溶出介質中,以40dip·min-1或5dip·min-1的頻率上下往復運動,振幅為2cm。試驗結果表明,不同的溶出裝置的溶出結果有 明顯差異,往復架法中40dip · min-1和5dip·min-1的試驗結果差異不大,說明流體力學對試驗結果具有較大的影響。綜合試驗結果表明往復架法,具有介質消耗少,重復性好,檢測靈敏度高等優點,更適于開展藥物支架的釋放研究的優點。
目前各國藥典都沒有收載藥物涂層支架類藥械 組合產品的溶出測定方法,使用最多的2種方法分別是流池法和往復架法。Katharina等采用流池法、改進流池法(VFTC) 和往復架法對使用流化床制備的藥物涂層支架模型進行體外溶解度考察,采用心血管內支架( 圖1-H) ,分別考察了2、10、75 mL溶出介質體積和 5、40dip·min-1往復頻率條件下的溶出行為,結果表明溶出介質的體積會對結果造成微小差異,在 75 mL 中溶出速率略快,分析原因為支 架與溶出介質產生了較大的機械應力導致洗脫支架骨 干發生性變; 而往復頻率對試驗結果幾乎沒有影響。綜合來看洗脫支架的初始釋放頻率較快,1d后釋放超 過55% ,2d 后約70% ,隨后釋放速率放緩,7d后達到90% ,14 d后基本釋放完成。相比14d 后流池法 (80. 6% ± 2. 0% )和改進流池法(78. 2% ± 12% ) 的藥物釋放量,往復架法的釋放量明顯更快。但在上市的CYPHER溶出度測試時間為90d,與文獻中往復架法測試結果相差較遠,因此溶出時間必須延長,以確保藥物完全溶 出。至于文中完全溶出時間較 短的原因可能是所建立的方法并沒有很好的模擬 藥物在體內組織中的情況,因此選用更可以模擬體內生理環境的溶出介質并優化試驗裝置,能建立更有效的制劑溶出方法,并建立體內外生物相關模型。
往復架法在設計之初是為了滿足透皮貼劑體外質量控制的需求,隨著透皮貼劑制劑技術的發展,往復架法的樣品架也由最初的往復碟逐漸豐富起來,傾斜碟、圓筒等往復架在透皮貼劑體外溶出中的應用也越來越廣泛。
往復架法具有可根據制劑的不同特性選擇不同的樣品架的優勢,越來越多藥物制劑開始嘗試使用 往復架法解決體外溶出過程中遇到的問題。目前除 透皮貼劑外,往復架法在緩控釋制劑、植入劑、大分子藥物的制劑、藥物涂層支架、陰道環等許多復雜制劑或藥械組合產品中也有應用。在這些復雜制劑或 藥械組合產品中更體現出了往復架法溶出度儀可改 變溶出介質pH和組成,溶出介質體積小,長時間自動運行的優點。在實際應用中,往復架法溶出度儀 尚存在溶劑揮發,噪音等問題。
往復架法溶出儀,相比其他溶出裝置,在樣品架、溶出杯等裝置部件的選擇上更具多樣性和個性化,為相關制劑研發階段的方法開發和質量研究提供了便利。隨著往復架溶出度方法在質量控制階段的應用和推廣,對裝置部件的標準化和儀器的重現性、耐用性提出了更高的要求。目前,暫未見公認的針對往復架法溶出儀的儀器性能評價方法和標準,尚待進一步探索研究。
近年來,國內外越來越多的企業、高校及科研院所逐漸將往復架法用于藥物的研究中,鹽酸哌甲酯緩釋片、帕利哌酮緩釋片等國內批準上市的藥物制劑已經采用了往復架法進行溶出度的測定。隨著制藥行業的不斷發展,透皮貼劑和緩控釋制劑等改良型新藥成為企業立項的熱點,眼部植入劑、大分子藥物的制劑、陰道環制劑、藥物涂層支架等特殊藥物制劑和藥械組合產品也日益得到關注,往復架法的引入將為相關制劑的質量研究和質量控制工作發揮積極的作用。
略
如需原文,請聯系小編(代老師15012941165)