時間:

作者:王 珊、花亞冰、高 翔等
注射用乳酸-羥基乙酸共聚物 (polylactide-polyglycolide, PLGA) 微球作為一種儲庫型釋藥系統, 自1989年第1個產品Lupron depot獲準在美國上市起, 已成功用于多種疾病的治療, 具備在體內幾天到幾個月長時間釋藥的能力, 可顯著改善用藥安全性, 提升患者順應性。體內外相關性(in vitro-in vivo correlation, IVIVC) 研究給微球制劑的發展帶來更多可能。IVIVC可以通過微球的體外釋放行為闡述體內釋藥的動態信息, 在表征微球性能的同時減輕各階段的工作量, 對藥物的研發、生產變更和監督管理等具有指導或支持作用。本文將注射用PLGA微球的釋放機制、體內外釋放測定涉及的常用方法和理論進行歸納總結, 重點討論了IVIVC尤其是A級IVIVC在微球制劑領域的建立及應用, 為進一步的微球體內外相關性研究提供參考。

微球是緩釋劑型的研究熱點, 是指藥物分散或被吸附在高分子聚合物基質中形成的微小球狀實體, 粒徑一般在1~250μm, 主要通過皮下或肌肉注射方式給藥。微球制劑制備方法多樣, 包括常用的溶劑揮發法、噴霧干燥法以及新興的相分離法、膜乳化法等。緩釋微球作為藥物長效遞送系統, 能夠在減少給藥次數的基礎上提供治療所需的穩定藥物濃度, 同時藥物被分散在高分子材料中可以改善其在人體內所處的微環境, 降低毒副作用, 用于蛋白多肽類等半衰期較短的藥物時, 可以提高生物利用度、增強藥物效力和穩定性。在制備注射用緩 釋微球的眾多可降解高分子材料中, 乳酸-羥基乙酸共聚物(polylactide-polygly‐colide, PLGA) 因具有較高的生物相容性而廣受關注。
近年來, 候選藥物大幅增加, 需要進行的臨床研究數量也加倍, 導致開發和監管的成本很高。同時, 在體內監測PLGA微球中藥物的釋放通常需要較長時間。因此, 尋找一些方法預測藥物的體內藥代動力學是符合現階段需求且十分有益的。體內外相關性(in vitroin vivo correlation, IVIVC)的概念由 Wagner等在1985年首次提出, 是一種用于預測的數學模型, 描述了藥物的體外溶出行為(通常是藥物溶出速率或程度)和體內藥代動力學過程(如血藥濃度或藥物吸收量)之間的聯系。IVIVC評價體系主要包括藥物的體外釋放研究、體內釋放研究和建立模型的數學處理方法3方面內容。通過IVIVC在體內外釋放行為間建立的定量、可靠的聯系, 測定藥物體外釋放行為就可以間接得到體內釋放結果。
不同制劑類型的釋放特點不同, 緩控釋制劑中藥物的釋放是體內吸收的限速步驟, 所以IVIVC在微球的各方面得到了成功的應用。本文簡要地對注射用PLGA微球IVIVC的評價體系進行歸納總結, 并敘述了IVIVC在微球制劑領域的應用情況, 以期為進一步的微球體內外相關性研究提供參考。
緩釋微球作為骨架型緩控釋制劑, 釋放機制主要分為兩類: 擴散和降解。微球制劑中藥物的釋放可以是單相、兩相或三相, 而大多數注射用 PLGA微球的釋放過程如圖1所示, 基本按照初始的表面釋放、釋放速率近恒定的滯后釋放和后期的加速釋放3個階段進行。
在早期, 制備過程中分配或吸附到微球表面、存在于孔隙內和近表面的藥物迅速釋放, 形成突釋。這一階段藥物釋放時間短、速率快, 通過控制擴散控制釋藥。因為藥物釋放速率與微球直徑成反比, 所以突釋現象可能被尺寸較小微球的釋放加劇。傳統的制備方法通常會得到一部分直徑小于5~10 μm的微球, 這些微球釋藥速度更快。研究人員發現, 在去除尺寸較小的微球后, 藥物初期的突釋效應較小或消失。此外, 水溶性藥物的突釋效應可能會更加顯著。在微球制備中, 此類藥物傾向于從油相分配或擴散到水相中,有吸附在界面上的趨勢, 使得親水性藥物更集中在微球表面。同時, 載藥量也影 響藥物的突釋。通常載藥量越大, 藥物的突釋程度越大。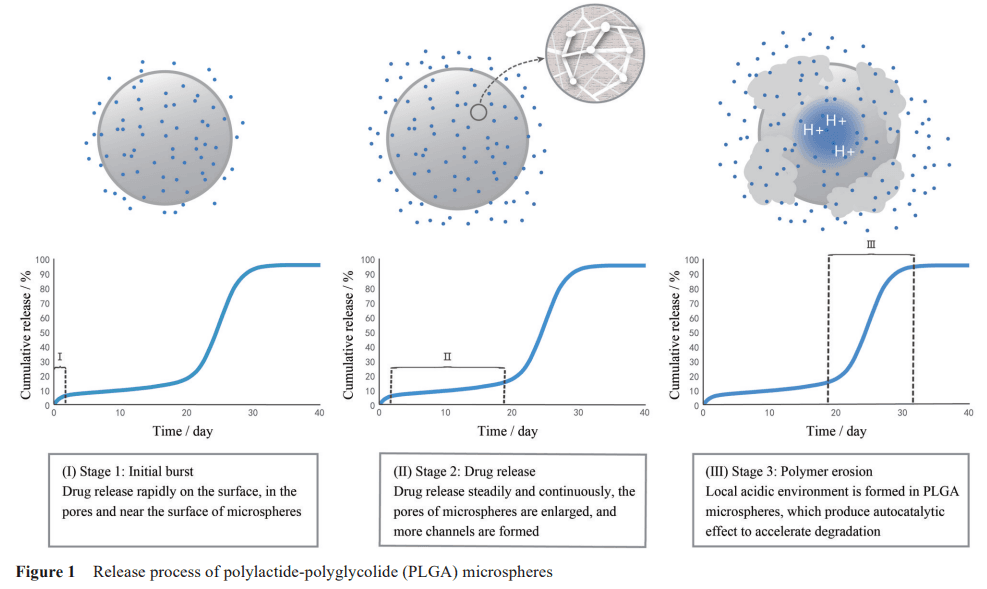
突釋后一段的釋放過程較為平穩。此時, 聚合物發生溶脹, 孔隙增大, 形成較多的孔道, 被包裹在聚合物內部的藥物借助孔道向外緩慢釋放。這段 時間內, 微球表面及近表面的藥物已基本溶出, 能夠進入微球的釋放介質有限, 可能使微球內部的藥物濃度飽和。同時, 外部釋放介質中藥物濃度近似于零, 使得內外形成一定的濃度梯度, 符合漏槽條件, 藥物釋放速率近似恒定。
最后溶蝕階段微球的釋藥速率較快, 受聚合物降解速率控制。實際上, 聚合物的降解伴隨在微球釋放的整個過程中, 只是在藥物釋放的尾聲, 聚合物鏈的快速水解斷裂加快了釋放進程, 并與聚合物的組成、分子量、結晶度和端基等特征相關。降解使聚合物長鏈變為短鏈, 增加了微球的孔隙率和親水性, 有利于介質進入, 微球形成相互交聯的藥物釋放通道, 最終不再具有整球形態。對于以 PLGA等聚酯材料為骨架的微球, 聚合物降解主要是酯鍵的水解, 偏酸或偏堿都能加速水解。同時水解過程中產生了酸性降解產物, 且這些酸的生成速率高于擴散和被中和的速率, 使微球內部生成局部酸性環境, 自催化加速降解。與較小尺寸的微球相比, 較大微球因為擴散距離的增加, 自催化效果更明顯。
體外釋放行為是藥物開發時必須考察的性質。同時, 微球制劑也需要測定體外釋放來指導藥物的體內釋放研究和體內外相關性的預測。在許多情況下, 沒有得到預測能力可靠的IVIVC是因為使用的體外釋放度方法對釋藥特征不同的微球處方不具備較好的區分能力。當測定方法更加準確地反映了釋藥行為, IVIVC創建成功的可能性就會增加。所以, 注射用PLGA微球體外釋放度測定條件和方法的選擇, 既要考慮藥物自身的性質, 也要著眼于與體內藥代動力學參數有較好的相關性上。
影響微球體外測定的因素主要分為兩類: 介質條件和試驗儀器。介質大多從藥物潤濕的角度對釋放行為產生作用, 主要有介質體積、pH值、離子強度、加入的表面活性劑、酶系統和緩沖系統等因素; 試驗儀器主要從流體動力學方面影響藥物的體外釋放測定,包括溫度、試驗裝 置、攪拌速度/流速和攪拌方式等。在實際操作時, 應通過調整釋放條件和/或方法來充分表達藥物的釋放行為。表1列出了美國FDA批準上市的注射用微球制劑常用的體外釋放方法和釋放介質。
3.1 體外長期釋放試驗
因為微球釋放行為的復雜性, 國內外都尚未制定針對微球的統一的體外釋放度測定方法。體外長期釋放測定的方法和條件一般是模擬體內的真實釋藥情況。值得注意的是, 測得的釋放曲線應該體現完整的釋放過程, 不能丟失藥物釋放的任何片段。
3.1.1 直接釋藥法
直接釋藥法應用范圍較廣, 它是將微球直接置于釋放介質中, 采用適當的裝置檢測藥物的釋放。該法可以通過恒溫水浴振蕩法、槳法和搖床法 進行。釋放介質的體積從幾毫升到幾百毫升不等, 滿足漏槽條件即可。某些情況下, 為了降低藥物降解產物在介質中積累產生的影響, 需要對緩沖液進行更換。該測定法簡單直接、結果較準確且易實現高通量。直接釋藥法的主要缺點有: 微球易漂浮在釋放介質表面, 易在介質中聚集; 取樣和介質替換過程中樣品的損失不可避免, 尤其是當釋放介質體積較小時,損失是不可忽視的。
Chen等將PLGA復合CaSiO3阿司匹林微球和CaSiO3阿司匹林微球分別置1mL磷酸鹽緩沖溶液(phosphate buffered saline, PBS) 中, 在37 ℃下利用直接釋藥法測定釋放曲線。結果與CaSiO3微球相 比,PLGA復合CaSiO3阿司匹林微球持續釋放超過40天,釋藥時間明顯延長, 體外緩釋現象明顯。Pervaiz等制備了一種新的基于不同聚合物比例的奧氮平微球,并采用恒溫水浴振蕩法對不同處方微球的體外釋放行為進行考察。將樣品置于PBS(pH7.4)中, 在37 ℃下水浴振蕩 (100 r·min-1)。結果表明, 其中PLGA(75∶25)和PLGA(85∶15) 的微球釋放周期大于30天, 具備穩定、長效的釋藥能力。
3.1.2 動態透析法
動態透析法是將微球置于含有釋放介質的透析裝置內, 隨后被放入含有大量相同介質的容器中進行試驗, 從外容器中取樣檢測。透析膜可以將測試環境分為兩個腔室。因為皮下或肌內注射給藥時微球會在組織內緩慢擴散, 所以膜透析儀器中非漏槽條件的膜內部分可以對應給藥部位, 符合漏槽條件的外部對應體內的血液循環。此法較好地模擬了體內真實釋藥條件, 且取樣和更換介質的簡便性更好。設置測定條件時, 透析儀器的內容積應至少比外部容積小6~10倍, 以 獲得足夠的動力使藥物被輸送到膜外。如果藥物與透析膜相互作用, 則應考慮其他方法進行測定。該方法的局限性在于透析膜內微球可能會聚集; 裝置中透析膜的擴散系數不會完全一致, 而且在時間的作用下, 同一透析膜的擴散系數也會改變。Kaihara等采用槳法和動態透析結合的方法對他克莫司微球的體外釋放行為進行評價。結果顯示, 透析法結合內攪拌的槳法得到的微球體外28天釋放度為 (92.3 ± 13.4) %, 并與體內行為的相關性 最好,表明該法是一種適合預測他克莫司微球體內釋藥的體外方法。
3.1.3 流通池法
流通池裝置具備更好的動態模擬人體體液循環的能力, 在國外廣受認可, 且已收載入2020版《中國藥典》四部附錄0931“溶出度與釋放度測定法”項下。流通池裝置分為循環式和開放式兩種, 前者是閉合式系統, 對于后者的開放式系統來說, 始終以新鮮釋放介質通過樣品, 和其他方法相比與人體環境更加接近。目前研究人員常加入比例適當的玻璃微珠來形成層流并防止微球的聚集, 適于難溶性藥物的測定。并且該裝置可將樣品固定阻止漂浮, 釋放介質的pH值、體積和流速也可隨需要進行調整, 具有靈活性。Rawat等制備了牛血清白蛋白PLGA微球, 并同時采用流通池法與恒溫水浴振蕩法進行體外釋放度檢測。因為減少了取樣時樣品的損失, 流通池法與恒溫水浴振蕩 法 相比, 具有更高的累計釋放百分比(高約12%)。所以針對該類蛋白質PLGA微球, 流通池法可以大限度地減少差異, 更符合真實釋藥現象。Zuo等在含0.1mol·L-1十 二烷基硫酸鈉的PBS(pH 7.4)中分別用搖床法和流通池法對羅替戈汀微球的體外釋放過程進行實時測定, 并將體內外釋放行為相關。結果表明, 兩法的體外釋放曲線相似, 得到的體內外相關性均較好, 相關系數均大于0.99, 但流通池法檢測到該微球初期的突釋, 更好地描述了體外的釋藥情況。
3.2 體外加速釋放試驗
由于微球的長效緩釋特性, 在體外模擬生理條件下藥物的釋放需要很長時間, 給各階段所必需的測定工作帶來不便。所以, 體外加速釋放試驗被用于提高藥物釋放效率, 縮短釋藥周期, 給微球的體外釋放提供快速、有效的評估途徑。目前可通過添加/調整溫度、pH值、有機溶劑、表面活性劑、酶和攪拌速率等方法進行微球的體外加速釋放, 其中應用較多的是升溫和調節pH值。
初期微球的突釋速度非常快, 加速條件下該階段釋放的時間更會縮短, 所以進行加速試驗時可能會發現釋藥曲線上的突釋階段難以辨別或丟失, 這時可以進行部分長期釋放研究來得到藥物的突釋特征。值得注意的是, 理想情況下同一處方的加速和長期釋放試驗會遵循相同的釋放機制, 但微球在較劇烈的條件下釋放機制有可能改變。總之, 因為是針對IVIVC研究的體外加速試驗, 所以得到的體外加速結果要與體外長期釋放或體內釋藥情況相關。
提高溫度既能通過增強基質分子的遷移性加速藥物擴散, 也能加速基質的水合作用和降解來加速溶蝕。聚合物玻璃化溫度(glass transition temperature, Tg) 是影響微球釋放的關鍵溫度點, 多作為選擇試驗溫度的依據。溫度在聚合物Tg以上時, 藥物的擴散系數可能成 倍增加, 有效地加速了微球的釋藥。Andhariya等分別考察了高溫(45 ℃) 和不同pH值 (4.5、6.0和9.0) 條件對納曲酮PLGA微球加速釋放的影響。結果表明, 升高或降低pH值后藥物變得不穩定。在45 ℃并加入抗氧化劑的條件下, 藥物穩定且在短時間內釋放完全, 得到的加速釋放曲線與長期釋放曲線擬合較好, 可預測該微球的長期釋藥行為。Chen等開發了基于恒溫水浴振蕩法的加速方法, 在50 ℃條件下得到了20(S)-原人參二醇PLGA微球的加速釋放曲線, 并與長期釋放結果比較。經擬合發現, 長期與加速試驗的相關性較好, 可用加速試驗替代長期釋放試驗對藥物進行評價。
。pH值通過影響聚合物的水解動力學來提高降解速率, 加速效果較升溫法溫和。Zolnik 等在 pH7.4的長 期釋放和pH2.4的加速條件下對不同分子量PLGA微球 (25K和70K) 的體外釋放行為進行考察。結果表明, 兩種微球處方在酸性和中性條件下都表現出三相釋放, 降低pH值沒有改變微球釋放機制, 低pH值條件只在最后階段加快了釋放, 前兩階段與長期條件下微球的表現相似。在pH2.4時, 低和高分子量的PLGA微球分別于19和52天釋放完全, 而常釋條件下藥物完全釋放需要30和84天。雖然該加速條件的效果不是很顯著, 不適于釋放周期長的處方, 但類似的加速條件可能對體內外相關性的研究起到幫助。
另外, 也可以同時考察多個參數來尋找較優的體外加速試驗條件。Xie等在釋放介質中加入乙醇和Tween 80, 同時采用程序升溫(0~1 h: 40 ℃、1~6 h:45 ℃和6~30 h: 50 ℃) 法對胸腺五肽微球進行加速試驗。結果3種分子量微球的體外加速結果與體內釋藥曲線的相關系數均大于0.97, 相關性好, 可采用加速釋放方法模擬體內釋藥。Hu等考察pH值、溫度、滲透壓和乙醇濃度對不同分子量的利培酮微球釋放的影響, 尋找最佳體外加速釋放條件并建立IVIVC對相關性進行評價。最終確定條件: 釋放介質為含20%(v/v)乙醇的PBS (pH 7.0, 0.1 mol·L-1), 溫度為45℃時, 體外加速釋放與體內釋放結果有較好的相關性, 可用來快速評價該微球的釋藥特性。
總之, 不論是體外長期試驗還是加速試驗, 都應以生物相關性作為重點指導依據。釋放度測定的條件和方法越接近體內正常的生理狀態, 就越有可能得到好的體內外相關性結果。
雖然微球的體外釋放試驗模擬了體內釋藥環境,但人體對PLGA微球的反應是一個復雜的過程, 藥物的釋放受很多因素影響, 如藥物在注射部位的分配、該部位可用液體量和肌肉注射時肌肉的運動情況等。同時, 也包括酶、脂質、自由基、過氧化物和吞噬細胞等生物活性物質對微球的影響。其中脂質等可充當增塑劑, 增加 PLGA的流動性, 有利于水進入微球; 機體引發異物反應產生的酸性產物、自由基等也可能加快聚合物的降解, 因此, 在大多數情況下, 微球在體內的釋放和降解會傾向快于體外。
探究藥物體內的釋放特征非常重要, 因為體內釋放行為最為直觀地展現了藥物的臨床性能, 為研究人員提供全面的藥物信息。同時, 微球制劑通常攜帶大劑量的藥物, 應該通過監測藥物在體內的行為評價復雜環境中藥物是否保持平穩釋放, 以保障用藥最基本的安全性。另外, 因為動物和人在物種上的差異性, 動物模型得到的結果不能完全推論到人體內。藥物開發時, 動物模型描述的體內釋藥行為可以用來構建體內外相關性, 但在監管中只有在人體進行的研究可以作為證明生等效性 (bioequivalence, BE) 或生物利用度的依據。與體外研究相比, 體內測定方法較統一, 目前微球體內釋藥研究主要采用以下兩種方法: 血藥濃度法和體內滯留法。
4.1 血藥濃度法
該法是在給藥后定時從動物模型或人體取血, 測定血漿樣品中藥物的濃度, 得到血藥濃度-時間曲線以評價體 內的藥物釋放行為。Yang等制備了鹽酸帕洛諾司瓊PLGA微球, 并定時從大鼠眼眶后穿刺采血,用超高效液相色譜-串聯質譜系統檢測得到藥代動力學數據并與靜脈內注射鹽酸帕洛諾司瓊溶液比較。體內研究表明, 鹽酸帕洛諾司瓊PLGA 微球與純藥物相比, 半衰期延長, 體內消除延緩, 顯示出穩定的血藥濃度水平(0.207~1.238 ng·mL-1), 達到了對藥物緩釋的期望。Zhang等采用固-微膠囊化工藝制備了恩替卡韋微球, 并從大鼠眶靜脈叢采集血樣, 通過高效液相色譜-串聯質譜法進行分析得到血藥濃度-時間曲線。研究人員發現該藥物體內釋放前期突釋不明顯, 血藥濃度較穩定, 可持續釋放42天, 表明制備 的微球在維持有效藥物濃度的前提下, 延長了恩替卡韋在體內的作用時間, 可滿足藥物長期治療的需求。
4.2 體內滯留法
體內滯留法是定時取出給藥部位殘留的微球,選用適宜方法測定藥物的殘留量, 再進一步得出藥物體內釋放度的一種方法。Liu等通過體內滯留法測定醋酸曲普瑞林微球在體內的釋放情況, 以確定該處方體內和體外加速釋放的關系。結果顯示, 微球在體內30天內的累積釋放量為88.32%, 體外加速釋藥曲線與體內釋放數據具有很好的 相關性(R2=0.993 8)。Zolnik 等給大鼠分別注射不同分子質量(13K和28K) 的地塞米松微球, 按時將包含微球的皮下組織從注射部位取出, 利用高效液相色譜分析后計算釋藥量。體內釋放曲線顯示, 13K和28K微球的初始突釋量分別約為48%和15%, 并分別在釋放的第8天和第12天達平臺期, 體內與體外釋放百分數也具有相關關系。
探究可能的IVIVC是尋找藥物體內外釋放關系的關鍵。事實上, 一個成功建立的IVIVC在微球藥物的整個生命周期中都能發揮積極的意義。
5.1 體內外相關性分類
2020版《中國藥典》將體內外相關性歸納為3類: A級: 體外釋放曲線與體內吸收曲線上對應的時間點具有點對點的關系。在A級IVIVC下, 兩條曲線可以重合或通過添加換算因子后重合, 獲得的信息量最大; B級: 應用統計矩原理將體外平均釋放時間與體內平均釋放時間或平均滯留時間進行比較。不能依靠B級IVIVC預測血藥濃度曲線; C級: 是特定時間點的釋放度 (如t50%、4h內的釋放百分比)與單個藥代動力學參數(如Cmax、AUC 或tmax) 相 關 聯。只 能 說 明 部 分相關, 缺乏預測能力。
5.2 A級IVIVC建立步驟
A級IVIVC被認為是體外釋放度和體內藥代動力學數 據相關關系最有力的證明。同時, A級相關也是監管機構認可的用于替代BE研究的唯一相關性。所以在微球制劑的研究中只有A級相關才有指導體內的實際意義和預測體內釋放的能力, 研究人員多致力于A級相關性的開發, 對B和C級別的IVIVC研究相對較少。如圖2所示, 一般微球制劑 A級IVIVC的建立步驟為: ① 選用不少于兩種釋放速率的處方, 獲得體外釋放度數據(最少檢測3個時間點以涵蓋釋放曲線的早期、中期和晚期)和體內血漿濃度數據。對于釋放與條件無關的藥物, 可以選擇一種速率的處方;② 對血藥濃度-時間曲線選擇合適的數據處理方法,將其轉換為體內釋放百分比-時間的曲線; ③判斷各時間點體內釋放百分比與對應體外釋放百分比的相關程度。通常采用最小二乘法進行線性回歸。
IVIVC必須采用具有不同釋放速率(以溶解百分比衡 量具有≥10%的差異)的處方建立, 以獲取更可靠、牢固的體內外相關性, 同時在外部預測能力評估中也可能獲得更好的結果。最終得到的IVIVC可以是線性, 也可以是非線性的, 這些結果都可能對藥物的釋放行為有較好的指示作用。
在創建IVIVC時, 有大量數據需要處理, 目前GastroPlus?、Simcyp Simulator?和WinNonlin Phoenix?等軟件工具可簡化繁瑣的計算步驟, 被用來快速、準確地得到IVIVC模型和預測能力的評估結果67。
5.3 體內釋放數據處理方法
體內外相關性的高低既與體外和體內測定的方法有 關, 也受體內釋放結果處理方法的影響。IVIVC建立的關鍵在于如何從微球的藥代動力學數據得到體內釋放度與時間的信息。
5.3.1 模型依賴法
傳統的依賴于隔室模型的瓦格納-納爾遜(Wagner-Nelson)法和盧-里格爾曼 (LooRiegelman) 法出現較早, 但仍是目前研究體內數 據 的常用方法。這兩種方法被認為是反卷積法的特例,與反卷積法的理論依據相同。如果給藥后具有明顯的一室模型 特征, 可利用Wagner-Nelson法得到藥物體內釋放曲線; 如給藥后體內的藥代動力學符合二室模型特征, 應使用 Loo-Riegelman 法。Shen等用直接釋藥法和流通池法 對不同工藝制得的利培酮微球體外釋放行為進行測定, 并將家兔實驗得到的藥時曲線用Loo-Riegelman法反卷 積, 建立IVIVC對藥物體內釋放參數進行預測。結果得到了A級IVIVC且模型擬合較好。經過驗證, Cmax的內部預測性是不確定的, 但外部可預測性符合要求。同時發現利培酮市售制劑Risperdal?的預測與實際AUC值差異僅為0.08%, 證明了建立的IVIVC不僅可用于預測處方相同制備工藝不同的利培酮微球的體內性能, 還可用于預測載藥量相似但組成不同的微球的體內行為, 以指導微球藥物處方或生產工藝的變化。
5.3.2 反卷積法
作為一種推導體內“釋放度-時間曲線”的數學方法, 反卷積法支持通過血藥濃度-時間曲線得到藥物體內釋放度數據, 也支持由體內釋放度-時間曲線 推導血藥濃度數據。該法的應用不受模型限制, 適于模型化困難藥物的研究, 且擬合結果準確可靠。Li等嘗試分別采用反卷積法和基于藥代動力學(pharmacokinetics, PK) 模型的模擬方法得到艾塞那肽雙壁微球的IVIVC, 利用直接釋藥法得到體外累積釋放量, 并從大鼠眼眶靜脈中取血分析得出藥代動力學參數。結果表明, 通過反卷積和模擬計算得出的微球初始突釋分別約為1.1%和1.2%, 得到A級IVIVC且模型擬合良好(反卷積和模擬方法的R2分別為0.982和0.984)。
5.3.3 其他方法
分數AUC法、直接測量法、基于PK模型的模擬方法等也被提出用于得到體內釋放度數據。分數AUC法不涉及消除速率常數, 在數據處理上更加簡便。Wang等采用恒溫水浴振蕩法測定3種PLGA分子量的醋酸戈舍瑞林微球體外的釋放行為, 用分數AUC法處理藥代動力學數據, 并將不同釋放速率的微球分別組合, 建立3個IVIVC模型。結果得到A級體內外相關性, 同時對模型的外部預測能力進行評估, 發現預測與實際的累積釋放曲線基本重合, 說明建立的IVIVC模型具備可預測性。D'Souza等對4種不同釋放速率的奧氮平微球用動態透析法表征體外釋放行為, 用Nelson-Wagner法和分數AUC法處理體內吸收數據, 并建立A級IVIVC, 發現采用Nelson-Wagner法和分數AUC法測定4種處方的體內釋 放曲線無明顯差異, 同時不論是4種處方分別建模還是建 立1個A級IVIVC, 這兩種方法得到的體內釋放曲線都與體外釋放行為表現出良好的相關性, R2在0.95到0.99之間。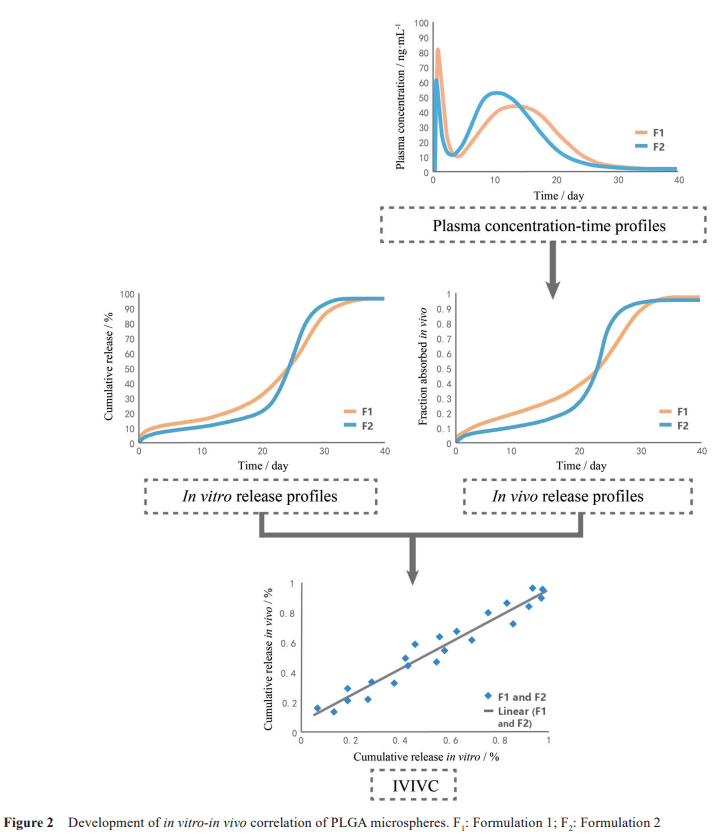
需要注意的是, IVIVC僅對當前研究的或相似的藥 物處方的工作是有效的。例如, 可使用同一IVIVC的處方需要與建模使用的處方具有相同的釋放機制和給藥途徑, 具有大致相同的生產工藝和處方組成等。
6.1 內部預測能力評估和外部預測能力評估
具備高度的預測能力是建立IVIVC的目標。所以,在使用建成的IVIVC之前的最后一步是對其預測能力進行評價。證明IVIVC模型的可預測性就是將某一體外釋放數據通過模型擬合獲得體內數據的預測值與觀測值進行比較, 得到預測誤差的百分比 (%PE)并分析是否超限。評價方法包括內部預測能力評估和外部預測能力評估。評估內部可預測性是用建模的初始數據進行; 驗證外部可預測性則應用非建模的體外數據。相比較而言, 可以知道外部預測能力是更可靠的, 因為基于新的數據對 IVIVC模型進行評估。通常, 除治療指數窄的藥物的模型和僅用兩種釋放速率處方建立的模型必須進行外部驗證外, 其他模型經評價確認具有內部預測能力可認為是有效的。
6.2 內、外部預測能力的評估指標
IVIVC通過預測體內生物利用度的誤差大小來被評價。因此, 目前將AUC和Cmax的預測誤差百分比作為評估指標。
內部預測能力要求單個處方AUC和Cmax的%PE ≤ 15%,且%PE的絕對平均值不大于10%; 如果得到的結果不滿足要求, 需要進一步評估外部預測能力作為IVIVC是否有效的最終確定。外部可預測性的標準規定 AUC 和 Cmax的%PE ≤ 10%; 如%PE在10%~20%之間, 還需使用額外數據進行研究; 若%PE高于20%, 通常表示可預測性不足。
Andhariya等制備了4種生產工藝不同的醋酸亮丙瑞林 (leuprolide acetate, LA) 微球,使用 LooRiegelman法處理微球的體內藥代動力學數據, 并將制劑組合建立兩個IVIVC模型, 同時進行內部和外部預測。結果顯示, 兩個組合都得到了A級體內外相關性(r> 0.97)。IVIVC1的Cmax外部%PE符合要求, 但AUC的外部%PE為-10.85%, 不在規定范圍內, 說明該IVIVC模型可預測性不足。IVIVC2的內部AUC平均%PE超限, 進而借助外部數據進行驗證。外部AUC和Cmax的%PE分別為1.52%和2.83%, 表明IVIVC2的外部預測能力較好。此外, 還研究了IVIVC2對微球產品Lupron Depot?的預 測 性。結果AUC和Cmax的%PE均在可認同范圍內, 證實建立的IVIVC2不僅可用于預測成分等效制備工藝不同的LA 處 方的體內行為,也可對成分不等效的LA制劑進行預測。
若檢驗結果在可接受范圍邊緣, 那么可以通過重建IVIVC模型、重新進行內外部預測能力評估、更改評估時選用的處方或優化體外釋放度的測定過程等方法再次評價。預測能力的評估是判斷建立IVIVC是否成功的唯一準則, 相關系數的顯著性檢驗結果較優只能表明在該模型中體內外釋放行為的相關關系好, 并不能代表IVIVC預測能力的高低。
體內外相關性研究正逐漸成為微球制劑開發和監管中關鍵的一步。目前IVIVC在PLGA微球研究中主要有3方面的應用: 生物等效性的替代、釋放度質量標準的制定和處方開發的指導。
在藥物開發和監管中常利用BE等指標來驗證藥物的一致性。因為藥物的BE結果用藥代動力學數據表示, 所以建立的IVIVC如果被接受, 那么就允許體外釋放度結果作為復雜耗時的PK研究的替代, 既滿足研究和監管中對BE的需求, 又不需要大量的人體試驗。體內研究的減免, 不僅可以節約資源, 而且加快了新處方合理性驗證、新藥申請、仿制藥開發和生產變更等進程。
釋放度是重要的藥物特征, 可作為定義產品規格、顯示批間的變化或一致性、評估制造工藝中任何變化的依據。釋放度標準通常是依照進行臨床或生物利用度試驗批次藥物的性質建立。利用連接體內外研究的 IVIVC制定的釋放度標準不僅可以作為質控的工具, 還可以被授予體內釋放相關性。這樣, 釋放度檢查就可以預測體內PK參數, 大大降低了通過檢驗的微球制劑在體內釋放出現問題的幾率。
處方可以在組成、制造工藝和制造設備等方面進行優化。在最初的處方探索階段, IVIVC可以體現各種因素的變化對藥物釋放行為的影響, 動物實驗的次數被大量地減少, 并有益于篩選出更理想的處方。
IVIVC可用來幫助識別與上市藥物臨床試驗結果可能相似的仿制藥處方。在Somayaji等的一項研究中, 建立了一種新型A級IVIVC用于篩選仿制藥處方。與傳統的A級IVIVC創建步驟不同, 他們將3種候選處方 (1、2 和3) 的體外釋放數據直接與參考上市藥物(reference listed drug, RLD)的體內釋放相關聯, 同時假設與RLD相關的曲線斜率接近45°的處方有更高的R2值。結果顯示, 處方2位于可接受的誤差界限內, 與RLD數據有較好的相關性, 表明利用改進的IVIVC篩選候選的長效微球處方將提高進行BE評估的資格, 即進一步對符合體內釋放試驗的候選仿制藥處方進行篩選, 可以減少臨床試驗數量, 加速仿制藥的開發。
負載藥物的PLGA微球已經成為緩控釋制劑研究的一個主流方向, 在臨床治療上擁有很大的優勢, 極具應用潛力。同時微球也是一種復雜的藥物劑型, 有很多影響其穩定性的因素, 如載藥量、包封率和骨架材料等。即使制備時加入等量的藥物、聚合物和輔料, 生產工藝中的一些微小改變也會在產品特征上體現, 因此加倍了藥物的評價工作。隨著 IVIVC 的發展, 這種局面得到了改善。
另外, 體內外相關性研究強調了體外釋放度的重要性。得到的體外結果被期望盡可能地復制體內釋藥行為, 所以沒有準確、重復性好的體外測定方法在一定程度上阻礙了IVIVC的發展。目前看來, 微球體外釋放度方法仍有很多值得思考的地方, 可以從藥物釋放機制和仿生溶出系統等方面進行更深入的探討。
建立IVIVC前, 需要評估建模的可行性, 正確理解藥物的性質和體內藥代動力學行為, 以及選擇可較好預測體內的體外測試條件; 建立模型后, 也需要 對IVIVC的預測能力進行客觀的分析。這是一項需要統籌規劃的工作, 涉及的內容較多, 但得到的可靠的體內外相關性結果將積極地推動微球制劑的后續發展。總之, 當下研究者努力的方向是在保證藥物性能的前提下改革常規程序, 減少動物和人體試驗, 更有效地進行藥物的研究和監管。所以, 科學的IVIVC對臨床前研究中處方的早期篩選和優化、已上市藥物的生產擴大或批準后的任何變化都起到了簡化的作用, 為復雜的評價方法找到了新途徑。
可以相信, 體內外相關性研究會得到更深入和廣泛的探索,將在注射用PLGA微球的整個生命周期中發揮更積極的指導和規范作用。
略
如需原文,請聯系小編(代老師15012941165)