時(shí)間:

作者:劉芳伶、范詩(shī)雨、周 群等
目的:流通池模擬難溶性藥物米拉貝隆緩釋制劑的溶出,建立米拉貝隆體內(nèi)和體外的相關(guān)性(IVIVC)模型,開(kāi)發(fā)具有預(yù)測(cè)能力的體外溶出方法。
方法:Loo-Riegelman法對(duì)三種不同釋放速率制劑的體內(nèi)血藥濃度進(jìn)行反卷積分獲得相應(yīng)的累積吸收百分?jǐn)?shù)(Fabs%),建立體外溶出目標(biāo)曲線。以純水為試驗(yàn)介質(zhì),流速4.0mL·min-1的試驗(yàn)條件下進(jìn)行制劑R(貝坦利?,50mg)和制劑T1、T2(50mg)的溶出試驗(yàn),通過(guò)高效液相色譜法測(cè)定溶出度,梯形面積法獲得制劑的累積溶出百分?jǐn)?shù)(Fdiss%)。
結(jié)果:立了米拉貝隆緩釋制劑體內(nèi)累積吸收與體外溶出度之間的A級(jí) IVIVC(回歸系數(shù)大于0.9), 制劑的外部預(yù)測(cè)誤差在規(guī)定范圍內(nèi)。
結(jié)論:研究建立的米拉貝隆緩釋制劑IVIVC模型經(jīng)驗(yàn)證具有較好的預(yù)測(cè)能力,該方法擁有的良好區(qū)分力及線性模型也可以為質(zhì)量控。

膀胱過(guò)度活動(dòng)癥(OAB)是一種以夜尿、尿失禁、尿急、尿頻為主要癥狀的泌尿系統(tǒng)疾病。OAB不僅會(huì)嚴(yán)重影響患者的生活質(zhì)量,而且也會(huì)給患者帶來(lái)巨大經(jīng)濟(jì)負(fù)擔(dān)。一項(xiàng)來(lái)自歐洲4國(guó)的調(diào)查結(jié)果顯示,過(guò)去40年OAB男女發(fā)病率分別為13.4% 和14.6%。在美國(guó),每年用于OAB的治療花費(fèi)接近十億美元。米拉貝隆是由日本安斯泰來(lái) ( Astellas) 公司研發(fā)的首個(gè)用于治療OAB的選擇性β3腎上腺素受體激動(dòng)劑。
美國(guó)食品藥品管理局(FDA)指南推薦將體內(nèi)外相關(guān)性(in vivo-in vitro correlation, IVIVC)作為預(yù)測(cè)性數(shù)學(xué)模型,用于描述劑型的體外特性(通常是藥物溶解或釋放的速率或程度)與相關(guān)的體內(nèi)反應(yīng)(如血漿藥物濃度或藥物吸收量)之間的關(guān)系。20世紀(jì)80至90年代,美國(guó)藥典(USP)/ FDA的研討會(huì)報(bào)告確定了IVIVC的發(fā)展目標(biāo)為“使用溶出度試驗(yàn)替代生物等效性試驗(yàn),并幫助制定溶出度規(guī)范”。米拉貝隆緩釋片于2017年在中國(guó)批準(zhǔn)上市,近5年間,國(guó)內(nèi)僅一家企業(yè)研發(fā)的米拉貝隆緩釋片通過(guò)一致性評(píng)價(jià),且國(guó)內(nèi)關(guān)于其溶出度/釋放度及IVIVC方面的報(bào)道較少,已有的相關(guān)研究主要考察自研制劑與參比制劑在四條曲線下釋放行為一致性。由于米拉貝隆屬于生物藥劑學(xué)分類(lèi)系統(tǒng)(biopharmaceutical classification, BCS)Ⅱ類(lèi)藥,低溶解度是藥物在體內(nèi)吸收的限制因素,因此該制劑適合開(kāi)展制劑IVIVC研究,建立具有預(yù)測(cè)能力的體外溶出方法。
本研究旨在利用流通池法對(duì)米拉貝隆緩釋片進(jìn)行IVIVC研究,用以區(qū)分空腹?fàn)顟B(tài)下制劑間的溶出行為,建立米拉貝隆的A級(jí)IVIVC,并評(píng)估模型對(duì)于藥動(dòng)學(xué)參數(shù)的預(yù)測(cè)誤差是否在標(biāo)準(zhǔn)范圍之內(nèi),這可能對(duì)監(jiān)管機(jī)構(gòu)的監(jiān)管審查、評(píng)價(jià)制劑間的差異提供幫助。
2.1 儀器
流通池(推薦使用華溶DS-7CP流池法溶出系統(tǒng));1260 型高效液相色譜儀(Agilent);BSA224S-CW 型萬(wàn)分之一電子天平 ;Vortex-5 型可調(diào)式微型渦旋混合器(上海嘉鵬科技有限公司);TGL16M 型高速冷凍離心機(jī);Eso-S15HUVF 型超純水儀(湖南啟沁環(huán)保科技有限公司);FE28 型pH 計(jì) ( 梅特勒 - 托利多國(guó)際貿(mào)易 ( 上海 ) 有限公司 );KS-600VDE/3 型數(shù)控超聲波清洗器(昆山市超聲儀器有限公司)。
2.2 試藥
米拉貝隆緩釋片(原研制劑,商品名:貝坦利 ?, 制 劑 R), 生 產(chǎn) 廠 家:Avara PharmaceuticalTechnologies Inc.,規(guī)格:50mg,批號(hào):20K2349;米拉貝隆緩釋片(制劑T1),批號(hào):210906,規(guī)格:50mg,由國(guó)內(nèi)某藥企提供;米拉貝隆緩釋片(制劑T2),批號(hào):20211011,規(guī)格:50mg,由國(guó)內(nèi)某藥企提供;乙腈(色譜純,MREDA);甲醇(色譜純,MREDA);乙酸銨(國(guó)藥集團(tuán)化學(xué)試劑有限公司);乙酸(國(guó)藥集團(tuán)化學(xué)試劑有限公司);水為純化水。
2.3 溶出儀試驗(yàn)裝置
全自動(dòng)流通池溶出儀主要包含溶出主機(jī)、計(jì)算機(jī)精密測(cè)控系統(tǒng)、自動(dòng)取樣系統(tǒng)、恒溫水浴等組成。溶出主機(jī)主要包含6個(gè)流通池,其直徑約2 cm,高約10 cm,流通池內(nèi)搭載內(nèi)循環(huán),以控制介質(zhì)的渦旋流動(dòng),兩端均配備由二氧化硅過(guò)濾墊片組成的過(guò)濾系統(tǒng),模擬藥物的吸收。試驗(yàn)過(guò)程中,恒溫溶出介質(zhì)通過(guò)操作控制系統(tǒng)集成的精密泵以精確穩(wěn)定的流速?gòu)牧魍ǔ氐撞窟M(jìn)入,樣品溶出液經(jīng)過(guò)濾系統(tǒng)進(jìn)入自動(dòng)取樣裝置,待至取樣時(shí)間點(diǎn)可自動(dòng)取樣。將藥物投放入流通池,計(jì)算機(jī)精密測(cè)控系統(tǒng)設(shè)置相應(yīng)參數(shù),即可開(kāi)始試驗(yàn)。
3.1 體內(nèi)研究
3.1.1?制劑R與制劑T1的生物等效性試驗(yàn)
采用單中心、隨機(jī)、開(kāi)放、兩制劑、三周期、三序列、部分重復(fù)交叉試驗(yàn)設(shè)計(jì)。委托海口市人民醫(yī)院開(kāi)展試驗(yàn),并經(jīng)其生物醫(yī)學(xué)倫理委員會(huì)批準(zhǔn) 審批件編號(hào):2018-( 倫審 )-144,志愿者對(duì)研究知情同意,并自愿簽署知情同意書(shū),30例體檢狀況良好的健康志愿者入組該試驗(yàn)。每周期志愿者分別服用米拉貝隆緩釋制劑T1或制劑R1片。分別在給藥前0h和給藥后0.5,1,1.5,2,2.5,3,3.5,4,4.5,5,6,8,10,12,24,48,72,96h采集血樣4mL,并保存在含氟化鈉的肝素鈉抗凝真空管中。離心(4℃、1700×g、10min)分離血漿后保存至 -80℃超低溫冰箱。采用經(jīng)驗(yàn)證的LC-MS/MS法測(cè)定血漿樣本中米拉貝隆的濃度。
3.1.2?制劑R與制劑T2的生物等效性試驗(yàn)
采用單中心、隨機(jī)、開(kāi)放、兩制劑、兩周期的自身交叉試驗(yàn)設(shè)計(jì)。委托長(zhǎng)沙泰和醫(yī)院開(kāi)展試驗(yàn),并經(jīng)其倫理委員會(huì)批準(zhǔn) 審批件編號(hào):(2021)第(53)號(hào),志愿者確定為體檢狀況良好的健康男性和女性,對(duì)研究知情同意,并自愿簽署知情同意書(shū)。16例志愿者每周期按隨機(jī)表單次空腹口服米拉貝隆緩釋制劑T2或制劑R1片。分別于給藥前0h及給藥后 0.5,1,1.5,2,2.5,3,3.5,4,4.5,5,6,8,10,12,24,48,72,96 h分別采集靜脈血約4mL并保存在提前預(yù)冷30min的 EDTA-K2+氟化鈉抗凝管中。離心(4℃、1 700×g、10min)分離血漿后保存至-80℃超低溫冰箱。采用經(jīng)驗(yàn)證的LC-MS/MS法測(cè)定血漿樣本中米拉貝隆的濃度。
3.1.3?藥動(dòng)學(xué)數(shù)據(jù)分析
人體單劑量口服米拉貝隆緩釋制劑R、制劑T1、制劑T2后的平均血藥濃度-時(shí)間曲線見(jiàn)圖1,各項(xiàng)參數(shù)比值(ratio)的90%CI 見(jiàn)表1、表2。在 R與T1對(duì)比研究中,R與T1的Cmax、AUC0-t和AUC0-∞3個(gè)參數(shù)幾何均值比(geometricmean ratio,GMR)的90%CI均在80%~125%范圍內(nèi),相較制劑R,制劑T1的吸收速度稍慢、吸收程度稍低。在R與T2對(duì)比研究中,所有藥動(dòng)學(xué)參數(shù)GMR的90%CI均超出了80%~125%范圍,提示制劑T2與制劑R未實(shí)現(xiàn)生物等效,制劑T2較制劑R的吸收速度更快、吸收程度更高。
3.1.4?目標(biāo)曲線的確立
采用WinNonlin8.2 軟件中的PK模塊對(duì)米拉貝隆制劑R的人體血漿藥物濃度-時(shí)間數(shù)據(jù)進(jìn)行房室模型擬合,根據(jù)其AIC值評(píng)估為二室模型。利用Loo-Riegelman法對(duì)米拉貝隆的兩項(xiàng)生物等效性(BE)研究中制劑R、制劑T1和制劑 T2的血漿藥物濃度進(jìn)行反卷積,解析體內(nèi)各時(shí)間點(diǎn)的累積吸收百分?jǐn)?shù)(Fabs%),即吸收曲線: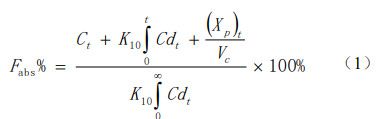
式中,Ct為t時(shí)間點(diǎn)的血漿藥物濃度,(Xp)t為 t 時(shí)間周邊室的藥物量,Vc為中央室的表觀分布容積,K10 為藥物從中央室消除的一級(jí)速率常數(shù)(由文獻(xiàn)報(bào)告的靜脈數(shù)據(jù)中求算獲得)。
如圖1-C所示,三制劑在6~8h間吸收完全,制劑T2累積吸收高于制劑R,與體內(nèi)BE結(jié)果相吻合;制劑T1與制劑R的累積吸收接近,說(shuō)明經(jīng)L-R計(jì)算出的三條累積吸收曲線可作為體外溶出的目標(biāo)曲線。
3.2 體外研究
3.2.1?制劑R與制劑T1和T2溶出試驗(yàn)
在選擇純水為溶出介質(zhì)、流速為4 mL·min-1、1.5 h自然溶脹后以 100mL·min-1 循環(huán) 6.5 h 的溶出條件下,分別于30,60,90,120,150,180,210,240,300,360,480 min 時(shí)間點(diǎn)采集樣本。利用 HPLC法在柱溫30℃,Agilent TC-C18 柱(4.6 mm×150mm,5μm,Agilent,USA),以乙腈 -50 mmol·L-1 的醋酸銨(3∶7,v/v)為流動(dòng)相,流速為 1 mL·min-1,檢測(cè)波長(zhǎng)為248nm的條件下測(cè)定樣品各個(gè)時(shí)間點(diǎn)的濃度。
3.2.2?溶出數(shù)據(jù)處理及分析
本研究采用的流通池法屬于開(kāi)環(huán)系統(tǒng),經(jīng)開(kāi)環(huán)系統(tǒng)溶出所得到米拉貝隆的濃度 - 時(shí)間曲線為濃度 - 時(shí)間曲線,經(jīng)數(shù)值積分轉(zhuǎn)換為累積溶出百分?jǐn)?shù) - 時(shí)間曲線,其公式 如下: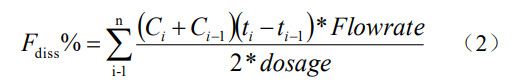
式中,F(xiàn)diss% 為累積溶出百分?jǐn)?shù),n 為體外溶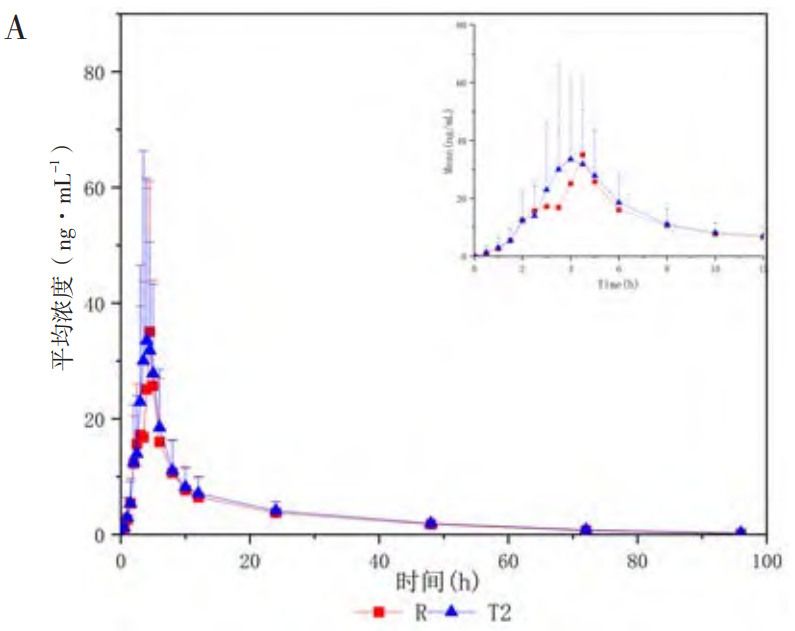
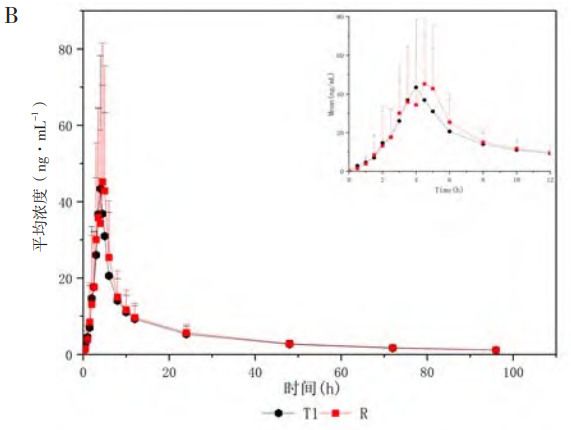
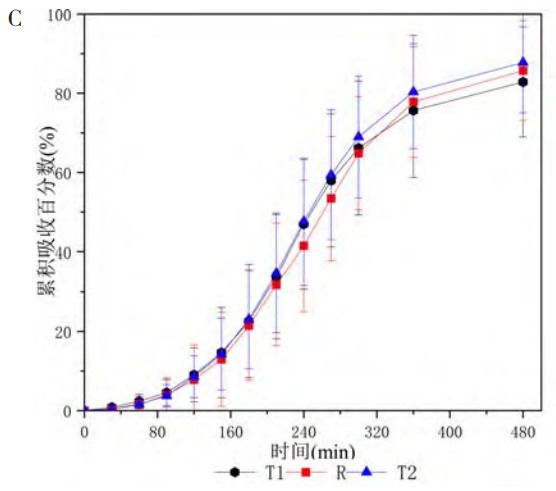 圖1 米拉貝隆緩釋制劑R、制劑T1和制劑T2的體內(nèi)血藥濃度-時(shí)間曲線及體內(nèi)吸收分?jǐn)?shù)-時(shí)間曲線
圖1 米拉貝隆緩釋制劑R、制劑T1和制劑T2的體內(nèi)血藥濃度-時(shí)間曲線及體內(nèi)吸收分?jǐn)?shù)-時(shí)間曲線
注:A.口服制劑R與制劑T1后的平均血藥濃度-時(shí)間曲線(n=30,Mean±SD);B.口服制劑R與制劑T2后的平均血藥濃度-時(shí)間曲線(n=16,Mean±SD);C.三制劑(R、T1和T2)的體外溶出目標(biāo)曲線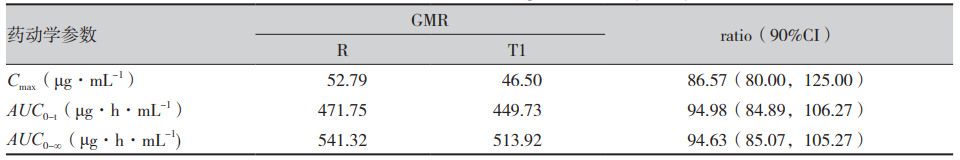
表1 空腹條件下米拉貝隆緩釋制劑R與制劑T1幾何均值比的90%可信區(qū)間(n=30)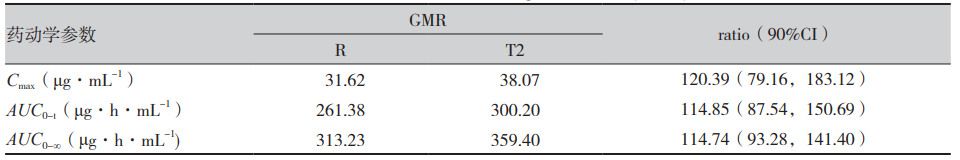
表2 空腹條件下米拉貝隆緩釋制劑R與制劑T2幾何均值比的90%可信區(qū)間(n=16)
出試驗(yàn)取樣點(diǎn)數(shù)量,ti為0~n中的第i個(gè)整數(shù)時(shí)間點(diǎn),ti-1為0~n中的第i-1個(gè)整數(shù)時(shí)間點(diǎn),Ci為ti時(shí)間點(diǎn)濃度,Ci-1為ti-1時(shí)間點(diǎn)濃度,F(xiàn)lowrate為溶出介質(zhì)流速,dosage為制劑規(guī)格。
以制劑R溶出曲線作為對(duì)照,微分溶出曲線(圖2-A)表明,制劑R與制劑T1在整個(gè)試驗(yàn)過(guò)程中溶出速度變化趨勢(shì)基本相似,2h后溶出過(guò)程較為平穩(wěn),實(shí)現(xiàn)了藥物從制劑中的緩慢釋放,展現(xiàn)出緩釋制劑的緩釋特性,而制劑T2在3h濃度達(dá)最大值時(shí)高出制劑R最大濃度的29%,溶出行為較制劑R差異大。同時(shí),累積溶出分?jǐn)?shù)-時(shí)間曲線(圖2-B)表現(xiàn)出制劑間良好的區(qū)分力,制劑T2在180min后累積溶出分?jǐn)?shù)高出制劑R約5%~10%,溶出速度快。三制劑在此溶出方法下所表現(xiàn)出的快慢趨勢(shì)與目標(biāo)曲線趨勢(shì)一致。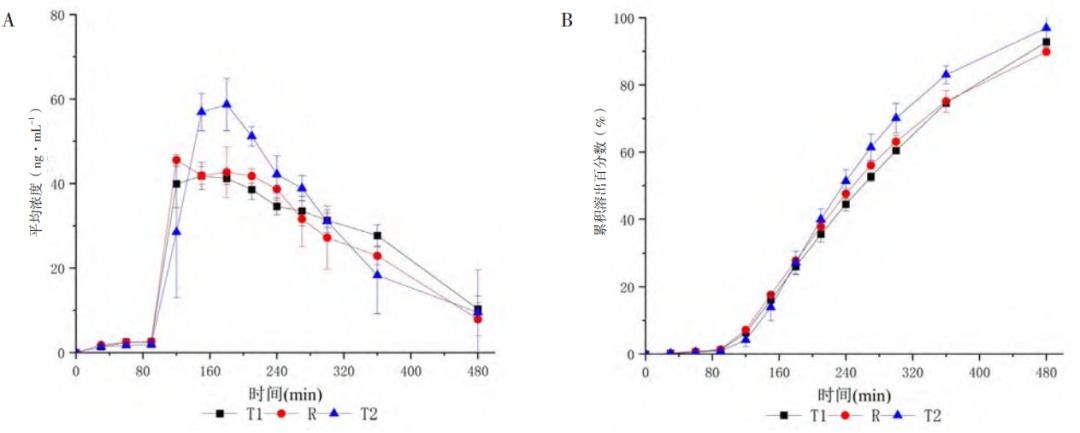
圖2 米拉貝隆緩釋制劑R、制劑T1和制劑T2的濃度-時(shí)間曲線(A)及體外累積溶出百分?jǐn)?shù)-時(shí)間曲線(B)(n=4,Mean±SD)
3.3 體內(nèi)外相樣性研究
3.3.1?IVIVC模型的建立
將任意兩種不同速率制劑的體外累積溶出分?jǐn)?shù)(Fdiss%,mean)作為自變量, 經(jīng)解析獲得的體內(nèi)累積吸收分?jǐn)?shù)(Fabs%,mean)作為因變量, 利用最小二乘法進(jìn)行線性回歸建立A級(jí)IVIVC(見(jiàn) 圖 3-A、圖3-B、 圖3-C)。制劑R與制劑T2建立的IVIVC方程為:Fabs%=0.9463Fdiss%+0.2451,R2=0.9906(P=0.940> 0.05)。制劑T1與制劑T2建立的 IVIVC方程為 Fabs%=0.9381Fdiss%+1.5570,R2=0.9879(P=0.931> 0.05)。制劑R與制劑T1建立的IVIVC 方程為:Fabs%=0.9681Fdiss%+0.4491,R2=0.9842(P=0.991> 0.05)。采用SPSS21軟件進(jìn)行獨(dú)立樣本t檢驗(yàn),計(jì)算95%CI。結(jié)果表明:?jiǎn)蝹€(gè)制劑由兩兩制劑建立的 IVIVC 模型方程所獲得的 Fabs% 與目標(biāo) Fabs%間差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。為了驗(yàn)證已經(jīng)建立的A級(jí)IVIVC,將比較三種制劑 Fabs% 實(shí)測(cè)值與預(yù)測(cè)值之間的差異,結(jié)果見(jiàn)圖3-D、圖3-E、圖 3-F。所有模型的回歸系數(shù)均大于 0.9,擬合優(yōu)度接近于1,滿(mǎn)足點(diǎn)對(duì)點(diǎn)的A級(jí)水平相關(guān)。制劑R與制劑T1和 T2間的預(yù)測(cè)吸收曲線與實(shí)測(cè)吸收曲線幾乎相吻合,表明建立的A級(jí)IVIVC具有良好的預(yù)測(cè)能力。
3.3.2?IVIVC模型預(yù)測(cè)能力評(píng)價(jià)
BCSⅡ類(lèi)藥物體內(nèi)藥物的吸收主要受限于藥物的溶出,認(rèn)為藥物進(jìn)入胃腸道內(nèi)的溶出過(guò)程等價(jià)于吸收過(guò)程 。根據(jù)FDA指南,單個(gè)制劑的藥動(dòng)學(xué)參數(shù)預(yù)測(cè)誤差小于10%時(shí),表明模型的預(yù)測(cè)能力較好。依據(jù)制劑R與制劑T2所建立的IVIVC模型獲得制劑T1相應(yīng)時(shí)間點(diǎn)預(yù)測(cè)的Fabs%,再利用如下卷積分公式獲得制劑T1各時(shí)間點(diǎn)藥動(dòng)學(xué)參數(shù):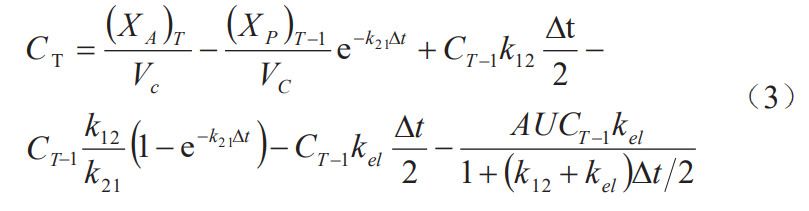
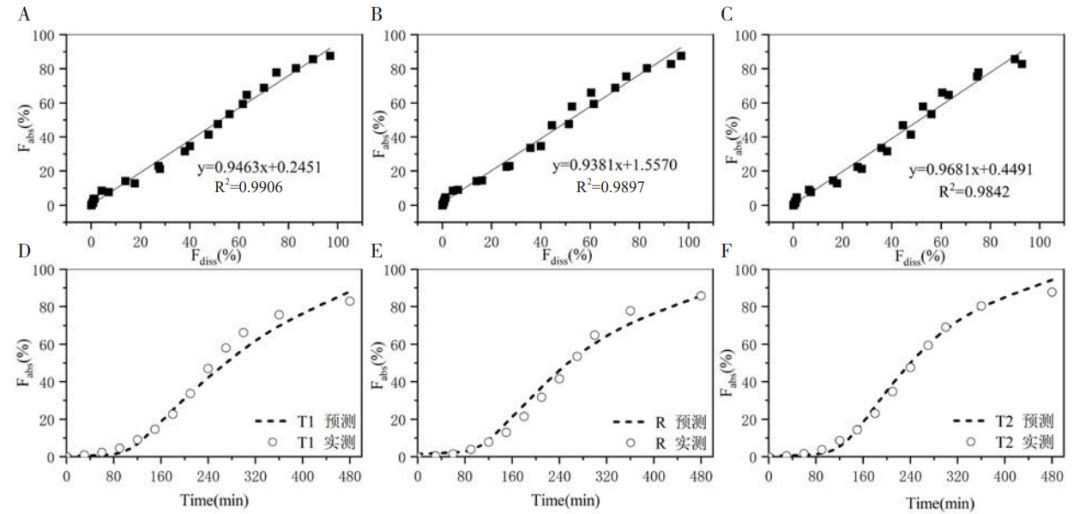
圖3 制劑R(制劑T1和制劑T2)預(yù)測(cè)吸收曲線與目標(biāo)曲線對(duì)IVIVC模型驗(yàn)證
式中,CT為T(mén)時(shí)間點(diǎn)預(yù)測(cè)血藥濃度,CT-1為T(mén)-1時(shí)間點(diǎn)濃度,(XA)T為T(mén)時(shí)間藥物吸收的總量,(XP)T-1為T(mén)-1時(shí)間周邊室的藥量,Vc為中央室表觀分布容積,K12與K21為藥物在中央室與周邊室間轉(zhuǎn)運(yùn)的一級(jí)速率常數(shù)(由靜脈數(shù)據(jù)求算獲得),Kel 為藥物從中央室消除的一級(jí)速率常數(shù);△t為t時(shí)間與t-1時(shí)間的差值。如表3所示,制劑T1的 Cmax、AUC0-48h 的預(yù)測(cè)誤差(PE)分別為0.46%,4.05%,預(yù)測(cè)誤差小于10%,IVIVC模型符合要求。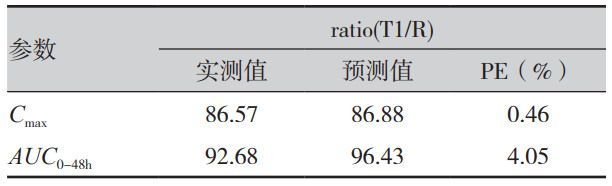
在米拉貝隆緩釋制劑的溶出行為研究中,倪冬勝的溶解度實(shí)驗(yàn)表明米拉貝隆的溶解度呈pH 依賴(lài),隨pH 增加而減小,0.1 mol·L-1的鹽酸條件下,原研制劑可在2h 內(nèi)溶出約40%,與目標(biāo)曲線中前120min 的累積吸收百分率未超過(guò)10% 的結(jié)果有一定差距,由此推測(cè)米拉貝隆可能主要不在胃部釋放。此外,歐洲公開(kāi)審評(píng)資料也顯示米拉貝隆主要釋放部位在腸道,于是本研究選擇了pH較高的介質(zhì)。并在進(jìn)行一系列條件摸索實(shí)驗(yàn)后發(fā)現(xiàn)在純水條件下,制劑R顯示出良好的相關(guān)性,這一結(jié)果也與文獻(xiàn)一致。故本研究選擇純水作為釋放介質(zhì)。米拉貝隆緩釋制劑是一種親水凝膠骨架型緩釋制劑,主要由親水性聚合物控制藥物的釋放。文獻(xiàn)表明,基質(zhì)吸水后會(huì)在基體表面形成凝膠層,折疊的聚合物逐漸打開(kāi),凝膠層逐步溶蝕,一般情況下,藥物主要通過(guò)聚合物溶脹和侵蝕的方式實(shí)現(xiàn)藥物的緩慢釋放。據(jù)此估計(jì)該制劑前期可能存在吸水溶脹的過(guò)程,所以本研究在經(jīng)時(shí)8h 試驗(yàn)過(guò)程中先進(jìn)行了1.5h無(wú)循環(huán)的自然溶脹過(guò)程。試驗(yàn)結(jié)果顯示在此條件下,制劑R 的累積溶出曲線整體呈現(xiàn)先慢后快的趨勢(shì),可與解析出的目標(biāo)曲線相吻合,表明該方法下體外溶出曲線可良好地反映出藥物在體內(nèi)的藥動(dòng)學(xué)過(guò)程。米拉貝隆屬于BCSⅡ類(lèi)藥物,以流通池為溶出裝置,難溶性藥物的漏槽問(wèn)題可在持續(xù)更換新鮮介質(zhì)的過(guò)程中得到解決。開(kāi)環(huán)式流通池序貫性模擬胃腸道的液體流動(dòng)狀態(tài),可真實(shí)客觀反映藥物在體內(nèi)的溶出行為。生物等效評(píng)價(jià)是以R與T1的藥動(dòng)學(xué)參數(shù)的幾何均值比的90%CI落在 80%~125%范圍內(nèi)為標(biāo)準(zhǔn)。本研究因客觀條件限制,兩項(xiàng)研究分別在不同的臨床試驗(yàn)機(jī)構(gòu)進(jìn)行,所獲得的藥動(dòng)學(xué)參數(shù)有一定的差異。在模型能力評(píng)價(jià)時(shí)采用比值比較,一定程度上可減小誤差,故本研究選擇對(duì)制劑T1的AUC與Cmax的預(yù)測(cè)ratio值與實(shí)測(cè)ratio值進(jìn)行比較。本研究中,建立的米拉貝隆緩釋片溶出方法可以實(shí)現(xiàn)A級(jí)相關(guān)性,可以顯著區(qū)分米拉貝隆緩釋片不同制劑間的溶出能力差異。該方法可以為米拉貝隆緩釋片的制劑開(kāi)發(fā)、處方優(yōu)化提供有力支持。
略
如需原文,請(qǐng)聯(lián)系小編(代老師15012941165)