時間:

作者:范詩雨,劉芳伶,賀勁杰,周群,程澤能
摘 要
目的 通過流通池法模擬富馬酸喹硫平緩釋制劑的體內(nèi)動力學(xué)過程,建立具有體內(nèi)外相關(guān)性的溶出方法,并進行體內(nèi)外相關(guān)性模型預(yù)測能力的評估。
方法 采用HPLC-MS/MS 法測得T1、T2 和R制劑的血藥濃度數(shù)據(jù),通過WinNonlin軟件的非房室模型和反卷積模塊解析參比制劑的體內(nèi)特征,依據(jù)參比制劑的體內(nèi)特征指導(dǎo)溶出方法的設(shè)計,用3 種釋放速率不同的制劑的體內(nèi)和體外數(shù)據(jù)建立體內(nèi)外相關(guān)性模型,并進行模型預(yù)測能力驗證。
結(jié)果 建立了具有A級相關(guān)性(R2=0.967)和C級相關(guān)性(R2=0.996)的溶出方法,內(nèi)部制劑預(yù)測和外部制劑預(yù)測的預(yù)測誤差PE%<10%,符合標(biāo)準(zhǔn)。
結(jié)論 本方法具有良好的體內(nèi)外相關(guān)性,其體內(nèi)外相關(guān)性模型經(jīng)驗證預(yù)測誤差符合標(biāo)準(zhǔn),對于吸收速率不同的制劑均具有良好的區(qū)分力,可以為富馬酸喹硫平緩釋片的制劑評價提供參考。
關(guān) 鍵 詞

01 簡 介
富馬酸喹硫平是英國AstraZeneca制藥公司新開發(fā)的第二代非典型抗精神病藥(second genera-tion antipsychotics,SGA)。其緩釋制劑可以延長藥物治療作用持續(xù)時間,降低毒副作用,減少用藥次數(shù),改善用藥的依從性。該藥物于2013年在中國上市,由于其仿制難度較大,目前國內(nèi)僅有3家仿制制劑為在售狀態(tài)。體內(nèi)外相關(guān)性(in vitro-in vivo correlation,IVIVC)模型是一種用于描述口服劑型體外特性(藥物溶解或釋放的程度)與體內(nèi)性能(血漿藥物的溶度和吸收量)之間相關(guān)性的數(shù)學(xué)模型。依據(jù)IVIVC模型對藥物體內(nèi)時間-血漿藥物濃度曲線的擬合程度,F(xiàn)DA指南將IVIVC劃分為A、B、C和多重C級4個級別。
本研究以富馬酸喹硫平緩釋片為研究對象,依據(jù)體內(nèi)藥動學(xué)特征來設(shè)計體外溶出方法,并初步建立和評估了該藥物的體內(nèi)外相關(guān)性模型。基于新型流通池法建立富馬酸喹硫平緩釋片具有體內(nèi)外相關(guān)性的溶出方法,依據(jù)藥物體外溶出行為來模擬預(yù)測藥物的體內(nèi)性能,這不僅有助于提高該制劑的生物等效性試驗的成功率、節(jié)約仿制藥研發(fā)成本、節(jié)省注冊時間,還可以被用于建立體外溶出度標(biāo)準(zhǔn),進行藥品批間質(zhì)量控制等。
02 儀器與試藥
全自動流通池型溶出儀(推薦使用華溶儀器DS-7CP PLUS 流池法溶出系統(tǒng));高效液相色譜儀(Agilent1260,配有 DAD 檢測器);UX6200H 型百分之一電子天平 [島津企業(yè)管理(中國)有限公司 ];十萬分之一電子天平[賽多利斯科學(xué)儀器(北京)有限公司 ];HH-6 型電熱恒溫水浴鍋(天津市泰斯特儀器有限公司);Vortex-5型可調(diào)式渦旋混合器(山海嘉鵬科技有限公司);TG20-WS 臺式低速離心機(湖南邁克爾實驗儀器有限公司);FE28 型 pH 計[梅特勒-托利多國際貿(mào)易(上海)有限公司],Eco-S15UVFV型實驗室純水系統(tǒng)(上海和泰儀器有限公司)。
受試制劑T1、T2(某公司自研產(chǎn)品,規(guī)格:200mg);受試制劑T3(某市售制劑,規(guī)格:200 mg);受試制劑T4(某市售制劑,規(guī)格:200mg);富馬酸喹硫平緩釋片(R,阿斯利康制藥有限公司,批號:MM2654、MK2374);富馬酸喹硫平原料藥(浙江蘇泊爾制藥有限公司,批號:011-180305U),磷酸二氫鉀(上海滬試,批號:20220110),氫氧化鈉(上海滬試,批號:20210107),磷酸(天津市科密歐化學(xué)試劑有限公司,批號:20210710);三乙胺(廣州光華科技股份有限公司,批號:20200809);鹽酸(成都市科隆化學(xué)品有限公司,批號:2020112502);富馬酸喹硫平對照品(純度:96.2%,批號:2413-025A2)、富馬酸喹硫平內(nèi)標(biāo)(純度:95.7%,批號:3298-096A6)(TLC pharmaceutical Standards);甲醇、乙腈、乙腈均為色譜純。
03 方法與結(jié)果
3.1 藥物體內(nèi)試驗
3.1.1 T1與R的人體生物等效性試驗
采用隨機、開放、兩制劑、兩周期(T-R、R-T)、自身交叉試驗設(shè)計,周期間的洗脫期為7d。試驗方案經(jīng)海口市人民醫(yī)院生物醫(yī)學(xué)倫理委員會 [ 倫理批準(zhǔn)號:2021-(倫審)-172] 批準(zhǔn),受試者均簽署知情同意書。48 例受試者在試驗當(dāng)日早上空腹口服 T1 或 R 一片,于給藥前(0 h)及給藥后 0.5、 1、2、3、4、5、6、7、8、9、10、11、12、13、 14、15、16、18、20、24、28、32、36、48 h 分別采集靜脈血 4 mL,血樣置于肝素鈉抗凝劑真空采血管中,1h 內(nèi)離心分離血漿,血樣放于超低溫冰箱(低于- 60 ℃)中儲存待分析,采用高效液相- 質(zhì)譜聯(lián)用(HPLC-MS/MS)測定人體血漿喹硫平濃度,采用 WinNonlin軟件非房室模塊計算富馬酸喹硫平的藥動學(xué)參數(shù)。
3.1.2 T2與R的人體生物等效性試驗
采用隨機、開放、兩制劑、兩周期(T-R、R-T)、自身交叉試驗設(shè)計,周期間的洗脫期為7d。試驗方案經(jīng)南華大學(xué)附屬第二醫(yī)院藥物臨床試驗倫理委員會[ 倫理批準(zhǔn)號:【202106-03】藥倫審字(191)號]批準(zhǔn),受試者均簽署知情同意書。48例受試者在試驗當(dāng)日早上空腹口服T2或R一片,于給藥前(0h)及給藥后 0.5、1、2、3、4、5、6、7、8、 9、10、11、12、13、14、15、16、18、20、24、 28、32、36、48h分別采集靜脈血4mL,血樣置于肝素鈉抗凝劑真空采血管中,1h內(nèi)離心分離血漿,血樣放于超低溫冰箱(低于-60 ℃)中儲存待分析,采用HPLC-MS/MS測定人體血漿喹硫平濃度。
3.1.3 生物樣本檢測
① 色譜條件。
色譜柱:Waters XBridge C18(4.6mm×50mm,3.5μm),流速:0.6 mL·min;進樣量:10μL;柱溫:35℃;流動相:0.1%甲酸水溶液為A泵,甲醇為B泵;梯度洗脫:0.00~1.00 min,80%A;1.00~1.5min,80%→10%A;1.5~4.5 min,10%A;4.5~4.6min,10%→80%A。
② 質(zhì)譜條件。
離子源:電噴霧離子源ESI;檢測方式:正離子MRM 模式;離子源噴霧電壓:4000V;離子源溫度:300 ℃;碰撞能:喹硫平內(nèi)標(biāo)和喹硫平的碰撞能均為25V;監(jiān)測離子對:喹硫平內(nèi)標(biāo)的檢測離子為m/z 392.2~258.1,喹硫平的檢測離子為m/z 384.2~253.1。
HPLC-MS/MS法測得各制劑單位時間的平均血藥濃度檢測結(jié)果見圖1a、圖1b,將各制劑的血藥濃度 -時間曲線數(shù)據(jù)代入WinNonlin 軟件中的反卷積模塊可求得各制劑的各時間點的吸收百分?jǐn)?shù)圖(見圖1c),各制劑的吸收速度和吸收程度差異明顯,T1>R>T2。采用非房室模塊計算富馬酸喹硫平的藥動學(xué)參數(shù),比較T1、T2和R制劑的Cmax、AUC0~t和AUC0~∞的幾何均值比Ratio(T2/R)和Ratio(T1/R),結(jié)果也說明在體內(nèi)試驗中T1的吸收程度比R高、吸收速度比R快,T2的吸收程度比R低、吸收速度比R慢(見表1、2)。
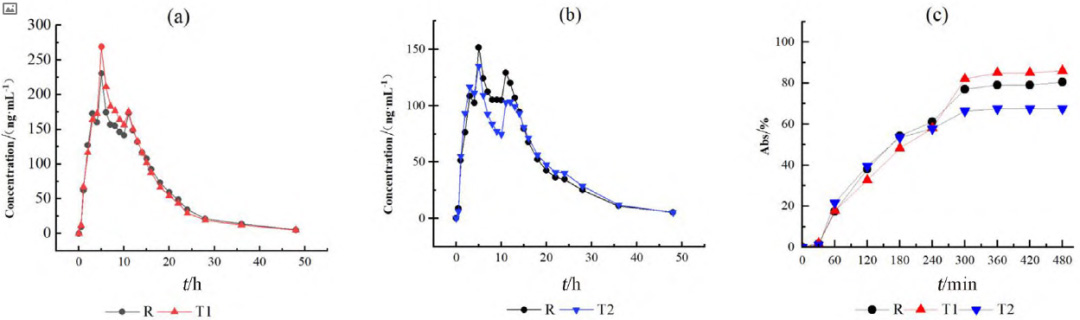
圖 1 平均血藥濃度 - 時間曲線圖(a 和 b)和體內(nèi)累積吸收百分?jǐn)?shù)圖(c)
表 1 T1 和R 的人體試驗藥動學(xué)參數(shù)
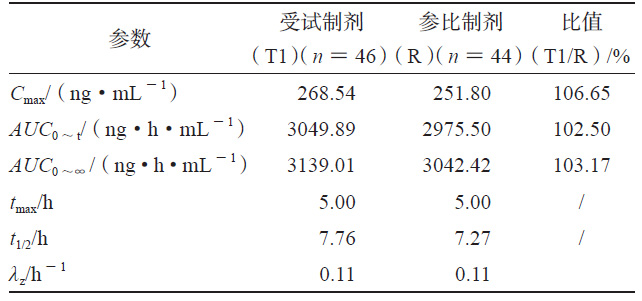
表 2 T2 和R 的人體試驗藥動學(xué)參數(shù)
3.2 藥物體外溶出試驗
3.2.1 藥物溶出度測定
由參比制劑體內(nèi)藥動學(xué)參數(shù)可知,富馬酸喹硫平緩釋片的體內(nèi)吸收速率常數(shù)Ka約為0.27,3倍吸收半衰期3t1/2約為8h,該數(shù)據(jù)提示富馬酸喹硫平參比制劑8h的累積吸收超過85%。以此為依據(jù),采用流通池法,溶出介質(zhì)前3h為pH1.2的鹽酸溶液,3h后為純化水介質(zhì),流速20 mL·min,溫度(37±0.5)℃,分別于0.5、1、2、3、4、5、6、7、8h接取1mL左右的溶出液,進行10 000 r·min,3 min的離心后,取上清液,采用HPLC法進行檢測,得到的喹硫平的微分溶出曲線通過數(shù)值積分法轉(zhuǎn)換為累積溶出百分?jǐn)?shù)曲線,轉(zhuǎn)換公式如下:
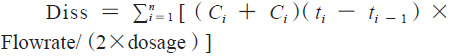
其中,Diss為累積溶出百分?jǐn)?shù),dosage為藥物活性成分總含量,Ci 為ti 時間點的藥物濃度,F(xiàn)lowrate為溶出介質(zhì)流速。
3.2.2 樣本檢測
使用HPLC檢測樣品中藥物濃度,色譜柱:Agilent 5 TC-C18(2)(150mm×4.6mm);流動相:甲醇-水- 三乙胺(600∶400∶4),調(diào)節(jié)pH至4.5;檢測波長:289nm;流速:1mL·min;柱溫:30 ℃;進樣量:10μL。
結(jié)果R、T1、T2 的8h體外累積溶出曲線和溶出速度具有明顯的差異,T1比R的溶出速率快,但T2比R的溶出速率略慢(見圖2),該試驗結(jié)果與各制劑體內(nèi)試驗不同時間的吸收百分?jǐn)?shù)呈相同趨勢(見圖1c)。
3.2.3 體內(nèi)外相關(guān)性的建立和評估
依據(jù)體內(nèi)外相關(guān)性模型計算體內(nèi)預(yù)測累積吸收百分?jǐn)?shù),再根據(jù)卷積分法計算體內(nèi)預(yù)測血藥濃度,具體公式如下:
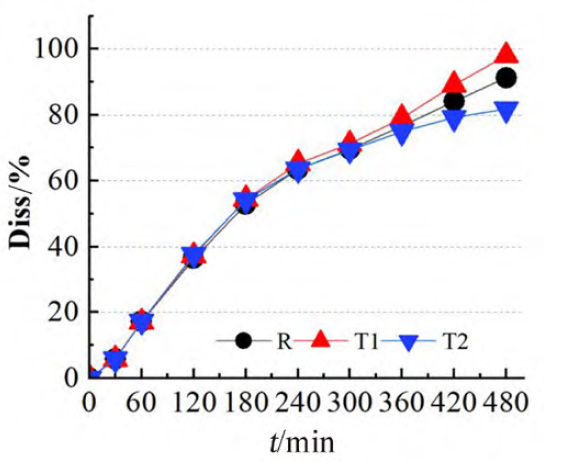
圖 2 T1、T2 和R的8h體外累積溶出百分?jǐn)?shù)圖(n=6)
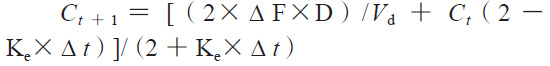
其中,Δ F是兩個連續(xù)的取樣時間點之間的累積溶出分?jǐn)?shù)差,Δ t是兩個連續(xù)的取樣時間點之差,D是藥物活性成分總含量,Vd是藥物的表觀分布容積,Ke是消除速率常數(shù)。
采用WinNonlin軟件計算累積吸收分?jǐn)?shù)(Abs,%),以三個制劑各時間點的體外累積溶出百分?jǐn)?shù)(Diss,%)為橫坐標(biāo),以對應(yīng)時間點的體內(nèi)累積吸收數(shù)據(jù)(Abs,%)為縱坐標(biāo)進行線性分析,可得到T1、T2和R的體內(nèi)外A級相關(guān)性模型(Abs=0.945×Diss+0.337,R2=0.967)。該結(jié)果表明該溶出方法具有A級體內(nèi)外相關(guān)性(見圖3a)。
使用DDsolver 程序?qū)Ω获R酸喹硫平緩釋片的溶出數(shù)據(jù)進行分析可知其體外溶出特征符合Weibull模型,并得到各制劑累積溶出80%的時間T80,以T80為橫坐標(biāo),體內(nèi)實測的AUC0~t為縱坐標(biāo)進行相關(guān)性分析,可得到三個制劑的C級相關(guān)圖(見圖3b)。
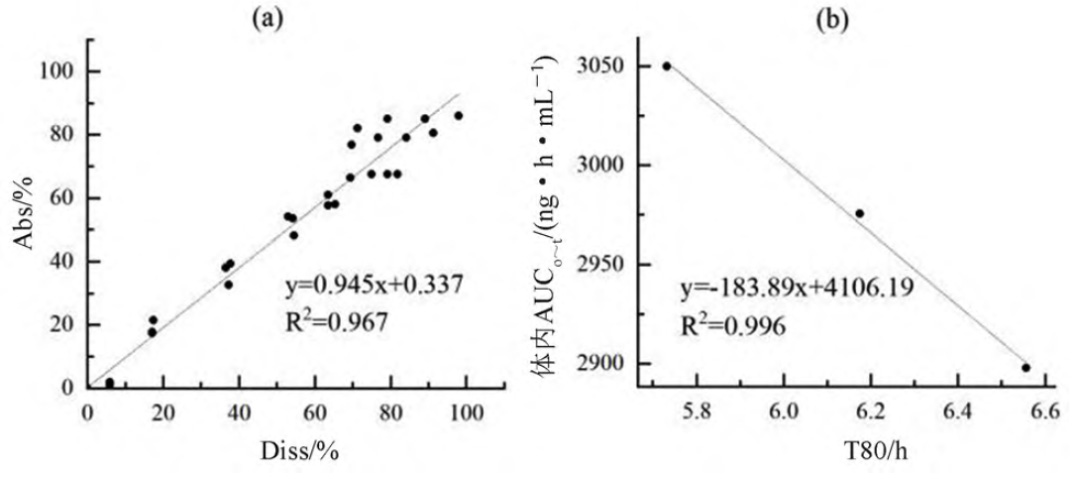
圖 3 T1、T2和R的A級(a)及T1、T2和R的C級體內(nèi)外相關(guān)性圖(b)
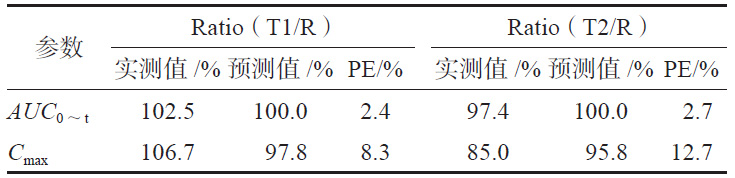
依據(jù)模型Abs=0.945×Diss+0.337,R2=0.967,由T1、T2 和R的體外累積溶出百分?jǐn)?shù)可預(yù)測三個制劑的體內(nèi)吸收百分率,由體內(nèi)吸收百分率通過卷積法可得到制劑的時間-血藥濃度數(shù)據(jù),進而得到Cmax 和AUC0~t預(yù)測的幾何均值比Ratio(T/R),并分別計算Ratio(T1/R)和Ratio(T2/R)的預(yù)測誤差率,T2制劑Cmax的Ratio(T2/R)為12.7%>10%(見表3),需繼續(xù)進行外部制劑預(yù)測能力評估。
表 3 T1、T2 模型預(yù)測值與實測值的比較
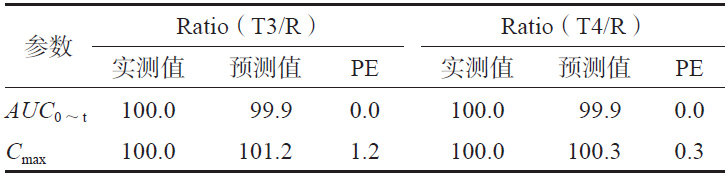
為進一步評估模型的可預(yù)測能力,使用市售制劑T3、T4 進行模型外部制劑預(yù)測能力評估。依據(jù)T1和T2建立的IVIVC模型(Abs=0.945×Diss+0.337,R2=0.967),由制劑T3、T4的體外數(shù)據(jù)各時間點的Diss(見圖4)預(yù)測制劑T3、T4 體內(nèi)各時間點的體內(nèi)吸收百分率Abs%,進而得到Cmax和AUC0~t預(yù)測的幾何均值比Ratio(T3/R)、Ratio(T4/R),將市售制劑T3、T4的實測值默認為100%,計算預(yù)測誤差率PE%,結(jié)果見表4。兩制劑Cmax 和AUC0~t 預(yù)測誤差率均小于10%,說明該模型的預(yù)測能力良好。
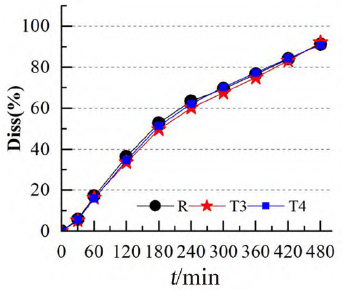
圖 4 參比制劑R 和受試制劑T3、T4 的體外累積溶出圖(n = 6)
表 4 受試制劑T3、T4 的模型預(yù)測值與實測值的比較(%)
04 討 論
文獻報道富馬酸喹硫平原料藥溶出呈現(xiàn)明顯的pH依賴性,溶解度隨著pH值的降低而增大,而人體胃腸道存在由酸性胃液到堿性腸液的過渡過程,考慮到胃腸道pH變化可能對藥物溶出速率產(chǎn)生的影響,本研究選擇了pH 1.2的溶液和純化水作為溶出介質(zhì),并且在3h的時間點進行了介質(zhì)的轉(zhuǎn)換。相比經(jīng)典的籃法和槳法,本研究選用的為流通池法,流通池的動力學(xué)過程與體內(nèi)的流體動力學(xué)過程更為相似,對于需要進行介質(zhì)轉(zhuǎn)換的試驗,流通池的儀器構(gòu)造比起籃法和槳法有更多的可操作性。對體內(nèi)吸收數(shù)據(jù)的解析也驗證了上述設(shè)計的必要性,將體內(nèi)數(shù)據(jù)和體外數(shù)據(jù)進行線性擬合后,A級相關(guān)和C級相關(guān)的擬合優(yōu)度R2均大于0.9,也說明了該溶出設(shè)計的合理性。
本研究的體內(nèi)試驗分為兩個獨立的試驗進行,雖然各試驗使用的參比制劑的廠家和批號相同,但在不同的試驗中得出的藥動學(xué)參數(shù)的具體數(shù)值仍差異較大,如參比制劑R在“T1與R的人體生物等效性試驗”中的AUC0~t和Cmax值均比“T2和R的人體生物等效性試驗”中的參數(shù)值大,為了減少誤差,在進行內(nèi)部預(yù)測和外部預(yù)測時選用的藥動學(xué)參數(shù)是幾何均值比 Ratio(T/R)這類比率值;在進行C級體內(nèi)外相關(guān)性分析時使用的T2制劑的AUC0~t也通過Ratio(T2/R)進行了換算。
目前,文獻關(guān)于IVIVC研究偏重于其所建立的溶出方法與體內(nèi)數(shù)據(jù)的相關(guān)性,以線性相關(guān)方程和擬合優(yōu)度R2作為IVIVC研究的結(jié)果指標(biāo)。實際上,IVIVC模型作為一種預(yù)測性的模型,其預(yù)測能力的評估也是IVIVC研究的重點,F(xiàn)DA建議對于三種釋放速率不同的制劑建立的IVIVC模型至少應(yīng)進行建模制劑內(nèi)部預(yù)測能力的評估,對于兩種釋放速率不同的制劑進行模型外部制劑預(yù)測能力的評估。本研究以三種釋放速率不同的制劑建立IVIVC模型,進行內(nèi)部制劑評估后發(fā)現(xiàn)T2制劑Cmax的Ratio(T2/R)的預(yù)測誤差為12.7%,略微超出10%的評價標(biāo)準(zhǔn),進一步用外部制劑T3和T4對模型進行了評估,外部制劑預(yù)測誤差均小于10%,符合評價標(biāo)準(zhǔn),說明模型具有良好的預(yù)測性。
05 結(jié) 論
本研究依托流通池法創(chuàng)建富馬酸喹硫平緩釋片體內(nèi)外相關(guān)性良好的體外溶出方法,對于吸收速率不同的制劑均具有良好的區(qū)分力,可為富馬酸喹硫平緩釋片質(zhì)量標(biāo)準(zhǔn)的建立提供依據(jù)。建立的IVIVC模型經(jīng)內(nèi)部驗證和外部驗證顯示其具有良好的可預(yù)測性,可通過富馬酸喹硫平緩釋片制劑的體外特征預(yù)測制劑的體內(nèi)特征,在制劑評價、處方優(yōu)化等方面都有重要的應(yīng)用價值。
06 參考文獻
略