時間:

翻譯:華溶應用中心
本篇文章提出了一種經過驗證的體外釋放測試方法,用于控釋腸道外長效微球。使用利培酮微球驗證USP4法(流池法)體外釋放試驗方法。進行了加速和實時釋放測試。加速方法明顯縮短了檢測時間,并與實時釋放曲線(樣本分析數量有限)有良好的相關性。采用加速條件進行方法驗證(耐用性和重現性)。耐用性測試結果表明,微球的釋放不受流速的影響,且不受方法的微小變化(如池體裝樣方法、微球上樣量、流通池大小和玻璃珠尺寸大小)的影響。隨著溫度的微小變化(±0.5℃),影響PLGA的催化降解,釋放曲線顯現了顯著的差異。當改變系統、設備或分析人員不影響釋放曲線,因此加速方法是可重復的。本工作確定了改進的藥典USP 4法用于微球藥物體外釋放測試可能性。
用于治療和預防各種疾病的注射用控釋制劑的數量預計將進一步增加,原因如下:(1)研究新發現的多肽和蛋白藥物不穩定,在胃腸道中滲透性較差;(2)基因醫學正從研究轉向臨床,這些產品需要腸外遞送;(3)藥物靶向治療變得越來越普遍(為了避免毒副作用,將昂貴的藥物定位在作用部位,并將藥物運送至體內其他無法到達的部位)。
注射用控釋制劑有以下幾種劑型,包括微球、脂質體、植入劑和藥物洗脫支架。這些產品大多是通過皮下(SC)或肌肉(IM)途徑注射給病人,藥物在體內的釋放時間長達幾周或幾個月時間。需要進行適當的檢測,來確保控釋制劑的安全性和有效性。與常規劑型不同,注射劑缺乏標準法規,特別是沒有一種標準方法來進行體外釋放試驗,用于產品質量的常規評估和產品開發中的處方優化,以及體內外相關性(IVIVC/R)的評估。目前使用的方法有“取樣分離法”和“透析法”,都未使用美國藥典的官方溶出釋放裝置。這使得實驗室間比較和監管批準審批困難。美國制藥科學家協會(AAPS)、國際制藥聯合會(FIP)、歐洲制藥科學家聯合會(EUFEPS)、控釋協會(CRS)、美國藥典(USP)、歐洲藥典(EP)、美國食品藥品管理局(FDA)和歐洲藥品評價機構(EMEA)舉辦的研討會強調了指導控釋藥品體外釋放試驗方法的必要性,建議盡可能使用簡單的方法或將其修改為新型的體外釋放試驗。
聚乳酸-羥基乙酸(PLGA)微球已成為最有前途的注射用控釋制劑之一。自1989年以來,FDA批準了許多注射用PLGA微球產品。用于微球體外釋放試驗方法有“取樣分離法”、“透析法”和“流池法”。然而,體外釋放曲線因使用的檢測條件而異。因此,這些產品需要有標準的體外放行檢測方法,用于減少釋放曲線的變化,并使實驗室內和實驗室間的方法轉移成為可能。
Zolnik等人開發了一種改進的USP4法(流池法),用于實時和加速測試條件下微球的體外釋放測試,并證明了USP4法相對于傳統的“樣品和分離”方法的優勢。除了幾何尺寸和操作精度(如流量、溫度等)外,改進的USP 4法(流池法)方法還具有以下優點:(1)微球與釋放介質可以分離;(2)可根據實驗需要靈活使用不同體積的釋放介質;(3)操作方便;(4)介質的蒸發量最小;(5)通過原位光纖實時監測釋放過程;(6)可自動化操作。然而,需要對改良USP4法進行驗證,以確保其適用于預期用途(例如作為微球質量控制的標準體外放行檢驗方法)。ICH-Q2A分析方法驗證指南將方法的耐用性定義為方法檢測能力不受參數微小變化的影響,并在正常使用期間提供其可靠性的指示。可通過在不同日期使用不同設備進行體外放行檢驗,并由不同分析員進行檢測,測定方法重現性。
注射PLGA微球是用于長期(數天至數月)釋放的藥物。因此,質量控制和制劑開發需要做體外加速釋放試驗。然而,應建立實時和加速方法之間的關系,以證明常規質量控制檢驗中使用的檢測方法的適用性。通過在高溫或極端pH條件下增加PLGA降解(酸或堿催化的PLGA降解),可實現PLGA微球藥物的加速釋放。預期藥物釋放機制在加速釋放檢測期間不會發生變化,因此可在加速和實時釋放曲線之間建立理想的1:1相關性。然而,在加速試驗條件下(極端pH或溫度),釋放機制可能發生變化。這種顯示不同制劑間至少存在等級順序相關性的方法可用于質量控制。
本文介紹了一種有代表性的控釋微球體外釋放試驗方法。使用改良的USP4(流通池)裝置開發了實時和加速釋放方法。驗證了加速方法的穩定性和重現性,并考察了使用改良USP4裝置獲得的釋放曲線重現性關鍵方法參數。本研究使用了商業化的25mg的利培酮長效微球注射劑。
2.1 材料
PLGA 65:35(MW: 95 kDa)(伯明翰聚合物公司);二氯甲烷、四氫呋喃(優級純)和乙腈(色譜級)(賽默飛世爾科技公司,賓夕法尼亞州匹茲堡);利培酮(西格瑪奧德里奇貿易有限公司,密蘇里州圣路易斯、Tecoland公司,新澤西州愛迪生);聚乙烯醇(PVA)(MW: 30-70kDa)、三氟乙酸(西格瑪奧德里奇貿易有限公司,密蘇里州圣路易斯);所有研究均使用純化水;利培酮微球長效注射劑(規格:25mg;批號:176921、168800、169941、9BA231、9BA237、8MA071、9MA575和8JA816;購自Ortho-Mcneil -Janssen制藥,康涅狄格大學學生健康服務藥房)。
2.2 方法
2.2.1 微球的制備
采用油-水(o/w)乳液萃取/蒸發技術制備了裝載利培酮的PLGA微球。將1克PLGA溶于4毫升二氯甲烷中。使用均質器將300mg利培酮溶解在PLGA溶液中,轉速為10,000 rpm,時間為30秒。然后將該有機相緩慢添加到20毫升1% (w/v)的聚乙烯醇(PVA)水溶液中,并在10,000 rpm下均質2分鐘。將該乳液添加到250毫升0.1% (w/v)的PVA水溶液中,在25°C下以600 rpm的速度在真空下攪拌4小時。將得到的微球過濾,用去離子水洗滌三次,真空干燥24小時。制備三份微球。
2.2.2 藥物和微球的表征
2.2.2.1 高效液相色譜法(HPLC) 使用高效液相色譜系統測定利培酮的濃度,紫外吸收檢測器設置為275 nm。流動相為乙腈:水:三氟乙酸(25:75:0.1%,v/v/v)。安捷倫C18色譜柱 (4.6 mm×15cm),流速設置為1ml /min。進樣量為30 μl。標準曲線包含預期未知(藥物)濃度的80-120% (0.1 ~ 20 μg/ml)。在0.5 ~ 20 μg/ml范圍內測定精密度、準確度和線性度。
2.2.2.2 測定利培酮的電離常數(pKa) 用玻璃電極(Fisher Scientific pH計)在25、40和45°C下電位滴定法測定利培酮的電離常數。在去離子水中制備0.001 M的利培酮溶液。用0.01 N鹽酸(HCI)滴定25 ml利培酮溶液(0.001 M)。用Henderson-Hasselbach方程計算利培酮在不同溫度下的電離常數(pKa)。所有測量都進行了三次,結果報告為平均值±標準差。
2.2.2.3 載藥量 將5毫克微球溶解在10ml四氫呋喃(THF)中,采用高效液相色譜法測定利培酮濃度。載藥量定義為:載藥量=(載藥量/微球重量)× 100。所有測量都進行了三次,結果報告為平均值±標準差。
2.2.2.4 粒度分析 使用AccuSizer 780A自稀釋顆粒粒度系統測定平均顆粒直徑。大約50毫克的微球分散在2毫升0.1% (w/v) PVA溶液。取200 μl分散液進行粒度分析。所有測量都進行了三次,結果報告為平均值±標準差。
2.2.2.5 玻璃化轉變溫度 采用Q100型差示掃描量熱儀(DSC)分析了微球的玻璃化轉變溫度。樣品從-40°C加熱到100°C,冷卻到-40°C,然后以20°C/min的速度再次加熱到100°C。使用了第一個熱循環測定微球的玻璃化轉變溫度(Tg)。所有測量都進行了三次,結果報告為平均值±標準差。
2.2.2.6 分子量測定 采用凝膠滲透色譜法(GPC)與蒸發光散射探測器(ELSD) 測定微球的分子量。流動相為四氫呋喃,流速為2 ml/min,溫度40℃。將10mg微球溶解在10ml四氫呋喃(THF)中,并通過0.45 um過濾器后進行GPC分析。使用Waters Millenium軟件進行數據收集和分析。采用聚苯乙烯標準(2000、900、824、400、200、110、43、18.80、17.60、6.93、2.61、0.98 kDa)進行校正,計算其平均分子量(Mw)。所有測量都進行了三次,結果報告為平均值±標準差。
2.2.2.7 微球降解 將10mg空白微球和利培酮微球置于6ml的pH 7.4磷酸鹽緩沖液中。將試管保持在40和45±0.2℃的水浴中孵育。每24小時取出三個空白和利培酮裝載微球的試管,最長4天。真空干燥24小時。使用GPC監測微球分子量變化,如第2.2.2.6節所述。
2.2.2.8 體外釋放度 使用閉環系統配置12mm標準小池的流池法進行實驗。在池體(12mm池體)中填充直徑為1 mm的玻璃珠至1/3位置。稱取大約10毫克的微球,并分成質量相等的三份。第一部分加在池體的玻璃珠上,然后蓋上一小勺的玻璃珠。剩下兩部分微球同樣的方法加樣。池體里裝滿玻璃珠直到池體上邊緣。用防靜電槍中和玻璃珠、微球和刮刀上的靜電,以方便樣品制備。250ml的 0.05 M pH 7.4磷酸鹽緩沖液(含0.1%疊氮化鈉),以8 ml/min的流速循環通過池體(裝有0.45 μm再生纖維素濾膜)。為了評價該方法的耐用性,考察了較大的流速(16 ml/min),較大的玻璃珠(直徑2.4-2.9 mm)和較大的池體(直徑22.6 mm)。此外,并使用以下方法進行裝樣:(1)分兩部分加入微球而不是三部分;(2)微球投樣量增加50%,改變溶媒pH值為pH 6.9和7.9。流池法的溫度分別維持在37±0.1℃和45±0.1℃,用于實時測試和加速測試。在加速測試中,溶媒溫度變化范圍為45±0.5℃。釋放試驗開始前,使用USP方法(USP通論<711>)對釋放介質進行脫氣處理。在介質瓶中使用氦氣噴射進行脫氣。在適當的時間間隔取樣并補液,以保持漏槽條件。所有藥物釋放試驗一式三份,報告結果為平均值+標準差。
使用商業化利培酮微球(Risperdal? Consta?)在改良的USP4(流池法)儀器上進行加速和實時體外釋放試驗。這些微球的載藥量和粒徑范圍分別為38% w/w和25-150μm。本實驗測定的微球載藥量為39.74±0.67% (w/w)。
3.1 實時和加速釋放曲線
在實時條件下(37°C)進行的商業化利培酮微球(Risperdal? Consta?)的體外釋放表明,最初的突釋量(24小時的釋放)為1.6%,隨后是約24天的遲滯期。遲滯期之后是藥物釋放期,從第24天到第40天(圖1)。通過將溫度從37℃升高到45℃進行體外加速釋放試驗。在加速條件下觀察到約2%的突釋(24小時釋放)。遲滯期從37°C下的約24天顯著減少到45°C下的4天。在加速條件下4天的遲滯期后是長達約7天的藥物快速釋放階段。藥物從微球釋放的總持續時間從大約40天減少到7天(圖2)。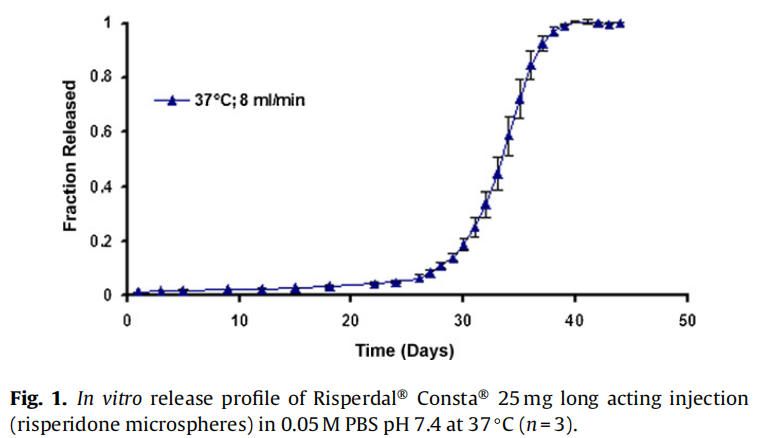
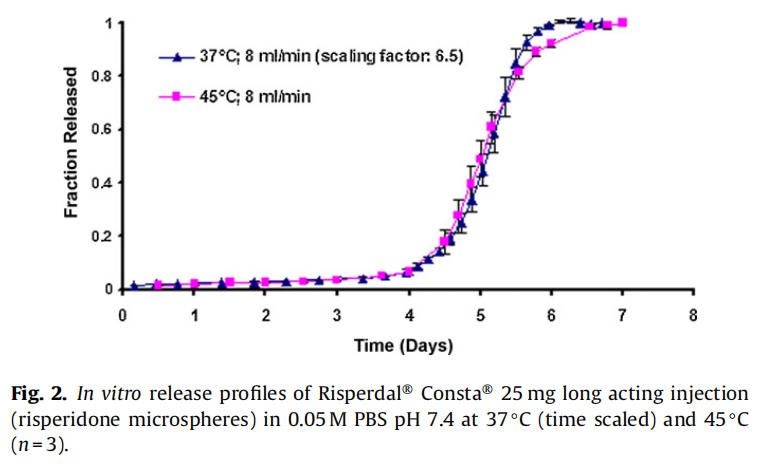
實時和加速釋放曲線在同一時間軸上通過時間縮放(縮放因子6.5)進行比較。如圖2所示,實時釋放曲線和加速釋放曲線經過時間縮放后重疊在一起。縮放因子為實時和加速釋放條件下釋放度為50%時的時間比值。實時條件下釋放的分數與加速條件下釋放的分數之間具有良好的相關性(在有限樣本分析n = 3時),相關系數為0.9929(圖3)。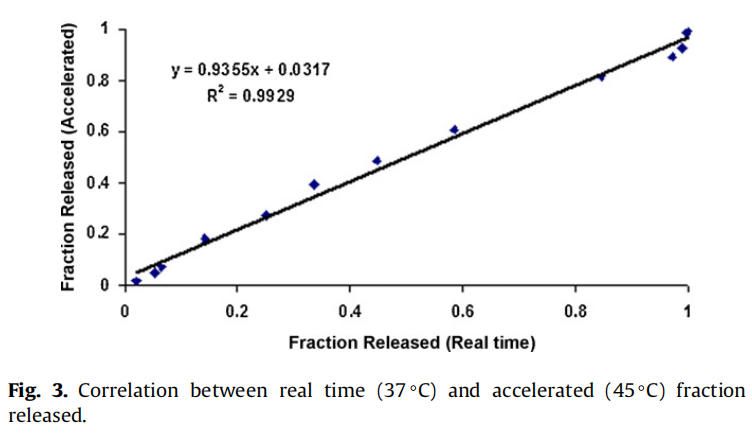
3.2 加速條件下藥物釋放方法的耐用性評價
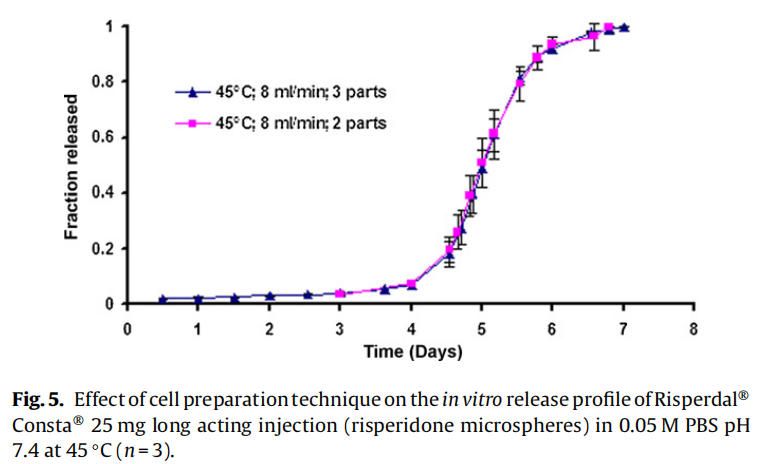
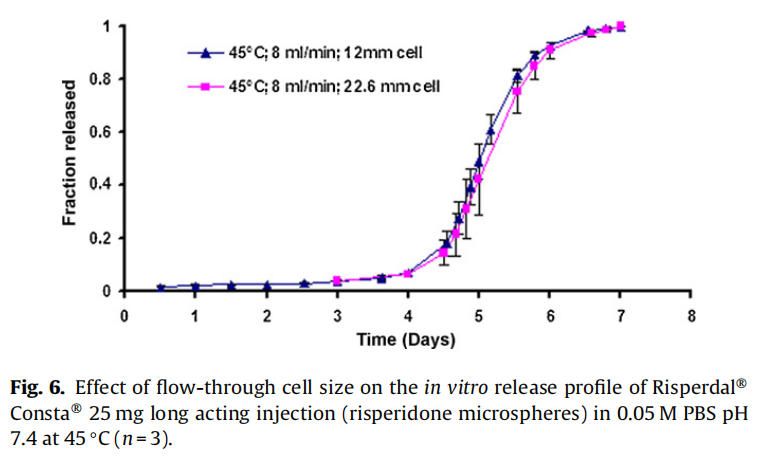
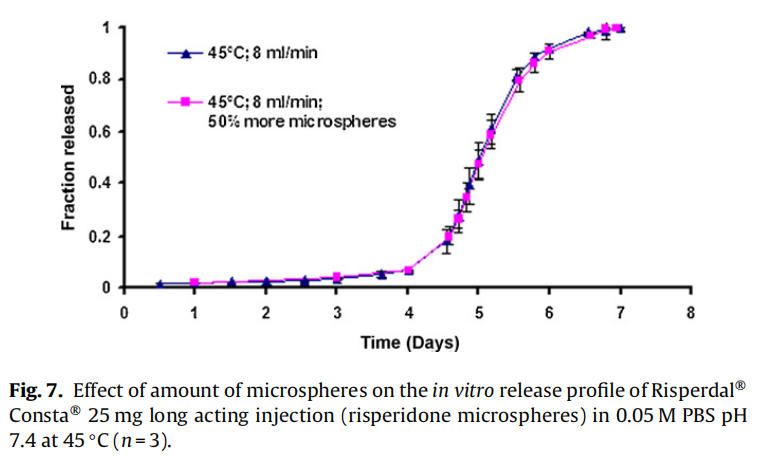
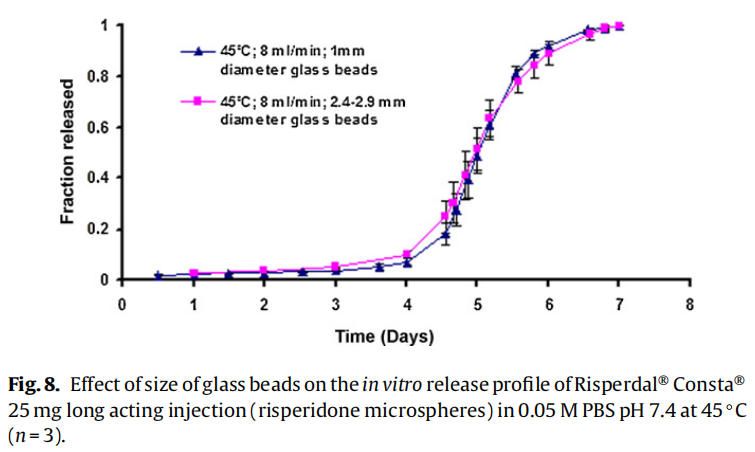
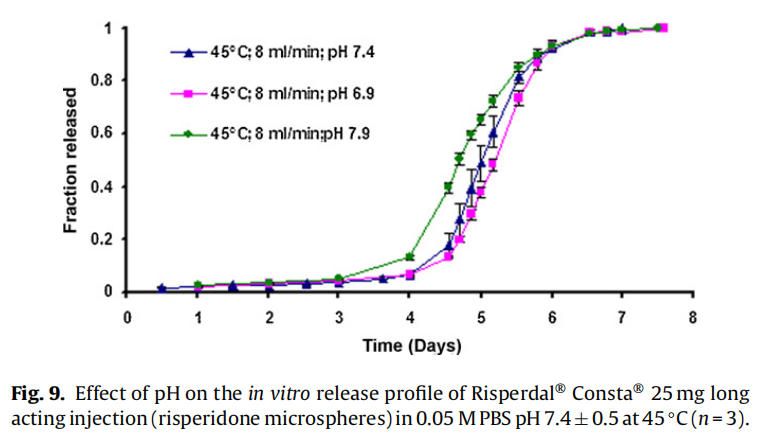
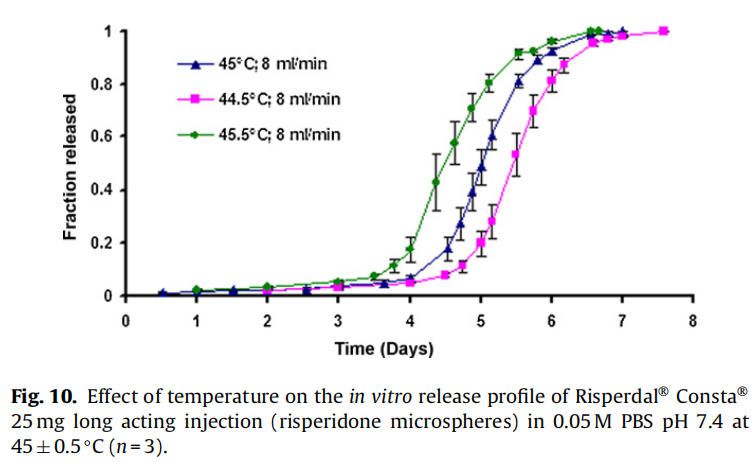
使用商業化利培酮微球對初始加速釋放條件進行了耐用性測試。通過有意改變方法參數,評估藥物加速釋放方法的耐用性:(1)流速;(2)上樣方法;(3)流通池尺寸;(4)微球上樣量;(5)玻璃珠的大小;(6)釋放介質pH值;(7)溫度。如圖4所示,微球體外釋放藥物不受流速(8和16 ml/min)的影響。如2.2.2.8節所述,在玻璃珠層中將微球分三等分和兩等份加入,對裝樣方式進行了評價。結果表明池體裝樣方式的不同對微球的釋放曲線沒有影響(圖5)。如圖6所示,流通池的大小變化(直徑12mm和22.6 mm)對釋放曲線沒有影響。增加50%的微球上樣量,對釋放曲線也沒有任何影響(圖7)。玻璃珠尺寸從1mm增加至2.4–2.9mm時,釋放曲線無變化(圖8)。釋放介質(磷酸鹽緩沖液)的pH降低0.5個單位(pH 7.4-6.9)時,觀察到釋放曲線略慢,當pH增加0.5單位(pH 7.4-7.9)時,釋放曲線更快(圖9)。釋放溫度變化±0.5?C對微球的釋放曲線有顯著影響,如圖10所示。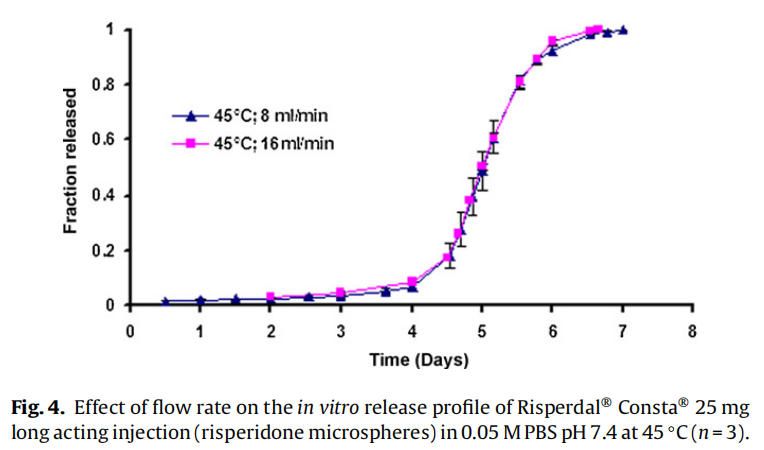
3.3 利培酮PLGA微球的溫度敏感性
制備空白微球和利培酮微球(如第2.2.1節所述),以進一步研究利培酮微球的溫度敏感性(圖10)。95 kDa(65:35共聚物比)的PLGA用于制備微球。如表1所示,市售和自制的利培酮微球特性不同。制備的利培酮微球的平均粒徑和載藥量分別約為7μm和14%(w/w),而市售微球的報告粒徑和載藥量分別為25-150 μm和38%(w/w)。市售微球的玻璃化轉變溫度(約48℃)高于制備的空白微球和利培酮微球(約40℃)。然而,兩種制劑(商用和制備的利培酮微球)的突釋相似(如第2.2.2.8節所述測定24小時釋放)(表1)。
從分子量隨時間的變化可以看出,與相應的空白微球相比,制備的利培酮微球降解得更快(如圖11)。與空白微球相比,制備的利培酮微球對5℃的溫差下(40℃和45℃)分子量變化也更高。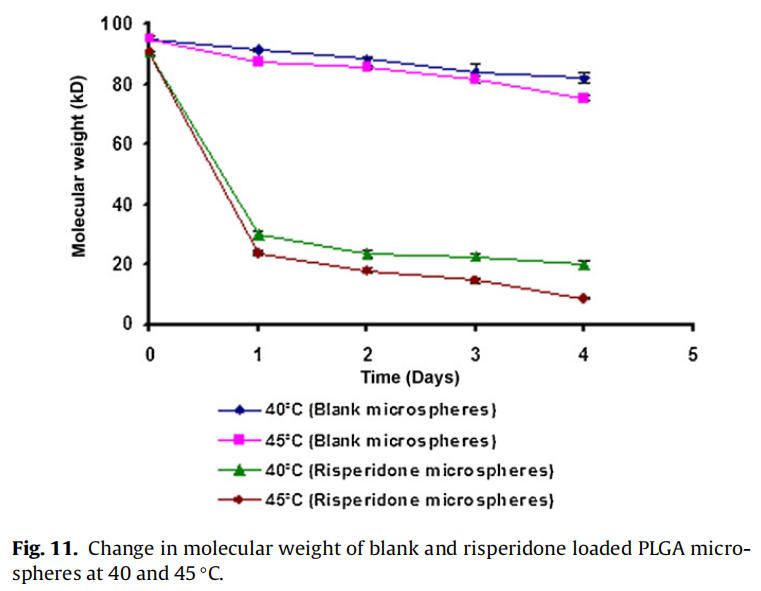
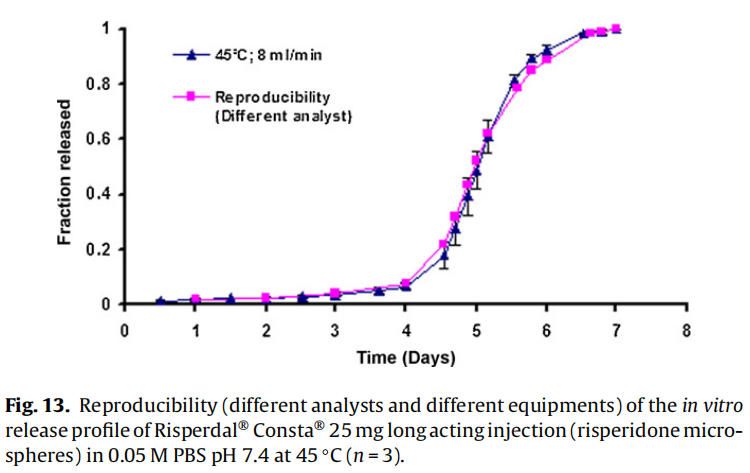
3.4 重現性檢測
體外釋放試驗(使用商業化利培酮微球Risperdal? Consta?)由:(1)同一分析員使用不同USP 4法系統進行,(2)由不同分析員使用不同USP 4法系統進行,以確定方法的重現性(圖12和圖13)。釋放曲線沒有變化,表明改進的USP4法(流池法)可用于微球的體外釋放試驗。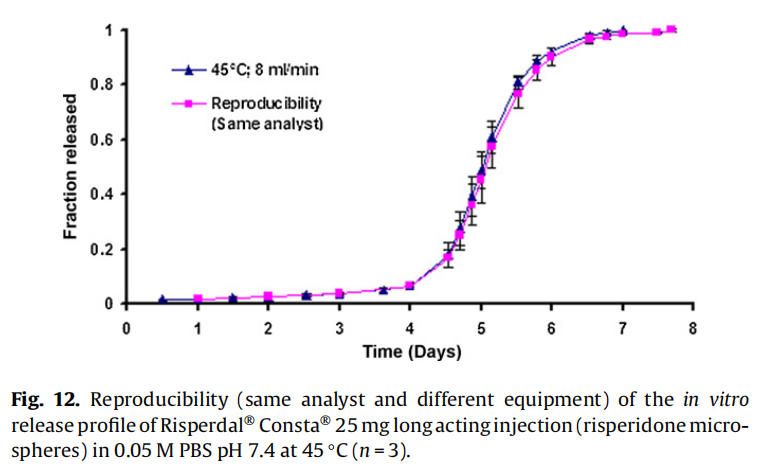
商業化微球(Risperdal? Consta?)表現出較小的突釋(在前24小時約1.6%),這可能是由于表面相關藥物的擴散所致。在體外實時釋放實驗中觀察到較長的遲滯期(約3周)被認為是由于聚合物侵蝕需要產生足夠的孔隙來促進藥物擴散和隨后的釋放。據報道,在滯后階段,這些微球的聚合物分子量從90 KDa變化到20 KDa。聚合物侵蝕和藥物擴散的結合被認為是高分子PLGA微球可能的藥物釋放機制(Zolnik et al.,2006)。因此,商業化微球(Risperdal? Consta?)的藥物釋放階段(4-6周)被認為是由于聚合物侵蝕和藥物擴散的結合。Ramstack等人報道,商用化利培酮微球(Risperdal? Consta?)的藥物釋放階段,聚合物分子量從20 kDa下降到小于10 kDa。
加速釋放測試顯著減少了商業化利培酮微球(Risperdal? Consta?)釋放的持續時間。實時釋放曲線(37°C)和加速釋放曲線(45°C)在時間縮放后重疊(圖2)表明,在高溫加速釋放測試中并沒有改變微球的藥物釋放機制。Zolnik等人(2006年)的工作支持了這一觀察結果,他們在高溫下進行的加速試驗遵循侵蝕控制釋放機制,并預測了37°C下的第二階段零級釋放。
對體外加速釋放試驗方法的耐用性和重現性進行驗證。耐用性研究表明,商業化利培酮微球(Risperdal? Consta?)的藥物釋放不依賴于流速變化而變化(圖4),這表明利培酮微球加速釋放為聚合物侵蝕的控制機制。類似的結果此前也有報道,流速變化(USP4法)對高分子量(25,28和70 kDa) 地塞米松PLGA微球的釋放沒有影響,因為藥物釋放機制是聚合物侵蝕控制的。由于藥物擴散控制釋放機制,低分子量PLGA微球(即5 kDa)觀察到流速依賴性的釋放過程(Zolnik et al.,2006)。
因為這些參數可能隨著分析員和實驗(在不同時間進行)的變化而變化,所以考察了流通池的池體裝樣方法和微球裝樣量的微小變化。該方法對裝樣方法(分為兩個或三個部分)和裝樣量有很好的耐用性(圖5和圖7)。評估了兩種不同的流通池尺寸(即12毫米和22.6毫米直徑),以確定在微球釋放方法中是否需要指定池體尺寸。流通池的尺寸大小對微球的釋放曲線沒有任何影響(圖6)。流通池的大小可以根據用于釋放實驗的微球的用量來選擇。直徑為1毫米的玻璃微珠通常用于USP4法中。有必要評估較大的玻璃珠是否對微球釋放有影響,因為玻璃珠的大小可以改變微球在池體中的分布(空隙體積的變化)以及微球周圍的流動模式。將玻璃珠的直徑從1mm增加到2.4-2.9mm對釋放曲線沒有影響(圖8)。直徑小于1 mm的玻璃微珠沒有被評估,因為它們可能會阻塞流通池的入口管路。在特定流速下,流通池大小的變化會影響池體內的流體動力學。然而,如目前工作研究,這不會影響聚合物侵蝕控制微球的釋放曲線。
堿性和酸性pH均可催化PLGA降解。當介質的pH增加0.5個單位(pH7.4到7.9)時,觀察到釋放更快。認為這是由于OH-離子濃度增加,PLGA降解更快。當pH降低0.5單位(pH 7.4至6.9)時,釋放曲線較慢,因為pH 6.9接近于中性pH,因此預期PLGA降解較慢(圖9)。
微球的釋放曲線對±0.5℃溫度變化較為敏感(圖10)。體外釋放度/溶出度檢測的允許溫度誤差范圍為0.5℃(USP溶出度通則711)。然而,該溫度范圍 (±0.5℃)不適用于對溫度敏感的利培酮微球類產品的體外放行檢驗。因此,需要將溫度控制在±0.1℃的范圍內,以獲得可重現的體外釋放曲線。
在微球包裹胺類藥物中,如硫嘧達酮,美沙酮和奎寧,觀察到胺催化的PLGA水解和隨后的更快的聚合物降解。Oster等人合成了胺修飾的支鏈PLGA,實現了聚合物的快速降解,用于DNA的遞送,發現隨著聚合物胺取代量的增加,降解速率也隨之增加。這種效應歸因于質子化胺基團增加了水的吸收和酸催化降解PLGA酯鍵(Oster et al.,2004)。Maulding等解釋了硫脲酮(胺類藥物)催化PLGA降解的原因是N-酰基銨離子中間體的形成,該中間體易于通過酯鍵裂解水解(圖14)(Maulding et al.,1986)。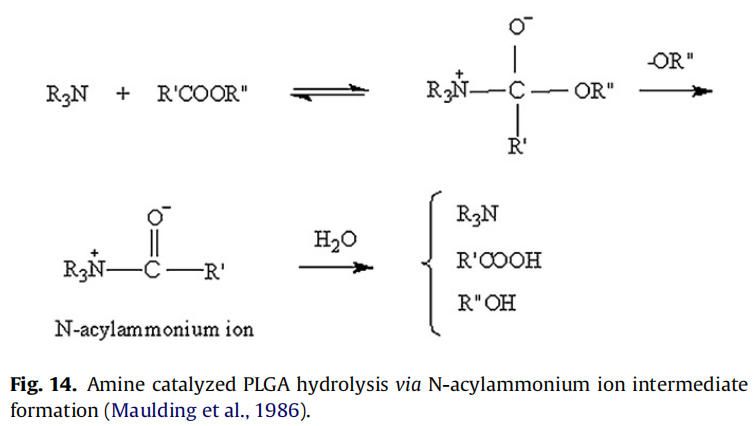
利培酮催化PLGA水解已被報道(Chue, 2003)。利培酮是一種胺類藥物,與哌啶氮相關的pKa為8.18(在20°C下),如圖15所示(Jug et al.,2009)。因此,在生理條件下(pH 7.4)哌啶氮的質子化可能是利培酮催化PLGA降解(酸催化降解)導致。實驗測定的利培酮pKa值(電位滴定;參見第2.2.2.2節),在25、40和45℃時分別為7.89±0.01、7.64±0.02和7.56±0.01。因此,在45℃的體外釋放條件下,預計利培酮中約59%的哌啶氮基團質子化(釋放介質pH 7.4;pKa 7.56(45℃時))。因此,考慮到微球的高載藥量(38%,w/w),在體外釋放試驗條件下,利培酮顯著的催化PLGA降解是可能的。據推測,這種催化反應的速率隨著溫度的小幅升高而增加了許多倍。為證實這一假設,使用乳劑/溶劑蒸發法制備空白和利培酮微球(參見第2.2.1節)。使用共聚物比為65:35,平均分子量(Mw)為95KDa的PLGA,其與商業化利培酮微球報告的PLGA分子量相似。但與商業微球中使用的PLGA共聚物組成(Risperdal? Consta?)是不同的。與制備的空白微球和利培酮微球(~40℃)相比,商業化利培酮微球的玻璃化轉變溫度(Tg)較高(約48℃),表明商業化PLGA微球中乳酸含量較高。由表1可知,制備的微球粒徑(約7μm)和載藥量(14%,w/w)均低于市售微球。這可能是由于配方/加工條件和所用聚合物的差異造成的。商業化利培酮微球和自制利培酮微球的突釋量相似。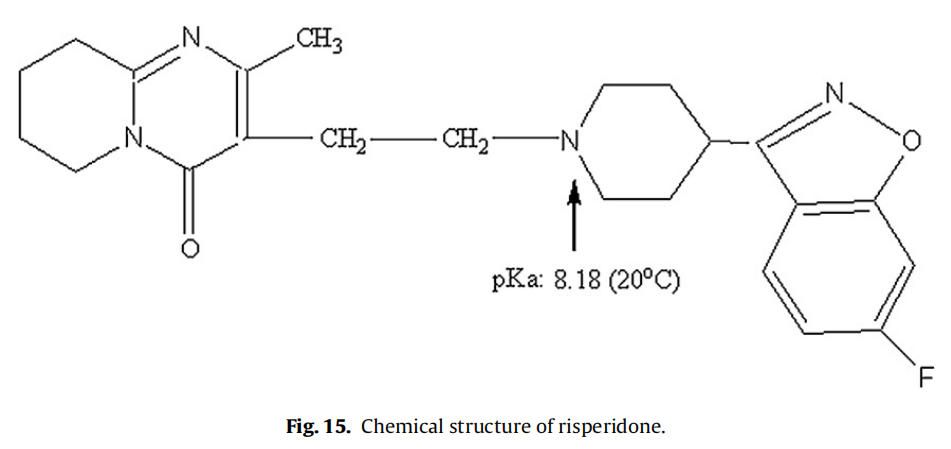
在40和45℃下,自制的利培酮微球的分子量明顯比空白微球下降得更快,這與前面解釋的胺催化PLGA降解的文獻報道一致。與空白微球(0天約為95 kDa)相比,制備的利培酮微球的初始分子量較低(0天約為~ 90 kDa)(圖11),表明發生在微球制備過程中也發生利培酮催化PLGA降解。所制備的空白微球和利培酮微球的降解率隨著溫度(40-45℃)的升高而增加,這是由于PLGA水解具有溫度依賴性(Wu, 1995)。所制備的利培酮微球的分子量隨溫度升高5°C(40-45°C)而大幅度下降,這表面利培酮催化PLGA降解速率隨著溫度升高而顯著增加的假設(圖11)。所制備的利培酮微球在45°C時降解更快,盡管由于pKa的減少,7.64±0.02(40°C)到7.56±0.01(45°C),質子化基團從大約63%(40°C)略微下降到59%(45°C)。結果表明,隨著溫度的升高,催化降解速率的增加抵消了質子化降低約4%的影響。使用自制的利培酮微球進行降解研究(在40和45°C),載藥量約為14% (w/w)。由于商業微球(Risperdal? Consta?)的載藥量較高(約為38%,w/w),溫度對PLGA降解的影響預計將更加明顯。這種行為可能是商業化利培酮微球(Risperdal? Consta?)在±0.5°C的溫差下釋放曲線具有顯著差異的原因(圖10)。
使用USP4法測試時,將pH和釋放介質溫度確定為利培酮微球體外釋放曲線可重現的關鍵參數。因此,應在體外釋放試驗中精確控制這些參數。然而,pH和溫度效應可能因包封藥物和聚合物特性(如分子量、結晶度和疏水性)而異。
除pH和溫度外,還觀察到溶解的空氣是影響體外釋放結果的關鍵因素(數據未顯示)。雖然溶出介質的初始脫氣對速釋制劑的溶出度檢測是有用的,但釋放介質通常在長期體外釋放檢測中又重新溶解空氣,這可能影響結果。推測微球(流通池中)捕獲到氣泡可能導致藥物釋放曲線變慢。體外釋放試驗期間的脫氣有助于避免這種變異性。
耐用性檢測結果有助于成功的重現利培酮微球的體外釋放曲線。該方法具有重現性,因為更換系統/設備或分析員不會影響釋放曲線(圖12和13)。方法驗證有助于確定改良的USP4法(流通池)作為微球體外放行檢驗標準方法的適用性。
改進的USP4法流通池被驗證有良好的穩健性和重現性,并被證明是微球體外釋放試驗的合適方法。這種方法似乎適合于適當的方法轉移調查后可能的藥典改編。市售Risperdal?Consta?微球的加速和實時釋放曲線觀察到一對一的線性相關。該工作強調需要選擇適當的加速測試條件,以便該方法在減少測試持續時間的同時能夠預測實時釋放曲線。該方法被證明是穩健的(相對于方法參數的微小變化)和可重復性的(改變設備或分析人員對釋放剖面沒有影響)。驗證結果表明,該方法易于應用于微球體外釋放試驗的實驗室。這項工作還提供了關于商業微球(Risperdal?Consta?)的溫度敏感性的重要信息,這是以前沒有報道過的。這些微球的溫度敏感性是由于利培酮催化PLGA降解對溫度的響應增加。這導致當測試溫度改變±0.5°C時,釋放曲線顯著不同。因此,本研究強調需要將商業微球(Risperdal Consta?)的體外釋放試驗溫度控制在±0.1°C的精度范圍內。這種嚴格的溫度控制預計不需要其他微球體系,除非所加入的藥物與PLGA具有類似的反應性。這種方法將有助于產品開發;質量保證;以及微球配方的監管審批流程。
對改良的USP4法的穩定性和重現性進行了驗證,證明其為微球體外放行檢驗的適當方法。這種方法似乎適合于進行方法轉移。對于市售的利培酮微球的加速和實時釋放曲線,觀察到點對點的線性相關性。該工作強調需要選擇適當的加速試驗條件,以便該方法除了縮短試驗持續時間外,還可預測實時釋放曲線。證明該方法具有耐用性(相對于方法參數的微小變化)和可重現性(設備或分析員的變化對放行曲線無影響)。驗證結果表明,該方法在微球體外釋放試驗的實驗室中易于調整。該工作還提供了有關利培酮微球的溫度敏感性的重要信息,先前尚未報告。微球的溫度敏感性是由于溫度升高時利培酮催化PLGA降解增加。當檢測溫度改變±0.5℃時,這導致釋放曲線顯著不同。因此,本研究強調需要將利培酮微球的體外釋放檢測溫度控制在±0.1℃的準確度范圍內。預計其他微球系統不需要進行這種嚴格的溫度控制,除非包裹的藥物與PLGA具有相似的反應特性。這種方法將有助于產品開發,質量保證,以及微球制劑的監管批準過程。
略 如需原文,請聯系小編(15012941165)