時間:

翻譯:華溶應用中心
審核:工業藥劑發燒友
兩性霉素B脂質體(AmBisome?),是一種救命的抗真菌產品,2019年銷售額為4.07億美元。AmBisome?具有相當復雜的物理結構,其中兩性霉素B(AmpB)與脂質雙層形成穩定的離子復合物,以保持AmBisome?在體循環中的低毒性和高穩定性。重現AmBisome?精確結構的失敗嘗試導致體外和體內的快速藥物釋放和高毒性。在這項研究中,我們建立了幾種分析方法來量化脂質體AmpB組分,表征脂質體的熱力學特性,并確定粒徑分布、AmpB聚集狀態和藥物釋放動力學。我們應用這些方法,結合體外溶血潛能和抗真菌活性測試,對多個批次的AmBisome?和印度批準的兩種仿制產品Phosome?和Amphonex?進行了表征。我們還使用了Fungizone?,一種膠束AmpB制劑,以及”泄漏”AmpB脂質體作為陰性對照。結果表明,Phosome?和Amphonex?都與AmBisome?相似,而Fungizone?和”泄漏”脂質體則在熱力學特性和AmpB聚集狀態方面均表現出差異,導致藥物釋放更快和毒性更高。由于制藥行業對制造仿制AmBisome?的興趣增加,并且缺乏表征脂質體AmpB產品的標準分析方法,因此,這里描述的方法對開發AmpB脂質體仿制藥是有價值的。

兩性霉素B(AmpB)是一種大環內酯類多烯廣譜抗真菌藥,對大多數臨床相關的真菌種類有效。AmpB的主要作用機制是結合敏感真菌細胞膜上的固醇,損傷細胞膜的通透性,導致細胞內的一些重要物質外漏,從而破壞細胞的正常代謝,抑制真菌生長。然而,AmpB還與哺乳動物細胞膜中的膽固醇結合,導致慢性腎毒性和幾種輸液相關毒性。為了減輕這些副作用,NeXstar制藥公司開發了AmpB脂質體制劑( AmBisome?),并于1997年獲得美國食品藥品監督管理局批準。與傳統的AmpB注射劑相比,AmBisome?的藥效時間更長,臨床毒性特征也更低,是一種更安全、更有效的真菌感染治療方法。2019年,AmBisome?全球銷售額達到4.07億美元。2016年該產品美國專利有效期使AmBisome?成為仿制藥生產的主要目標。然而,迄今為止,尚未獲得美國食品藥品監督管理局批準的AmpB脂質體仿制藥。
研發AmBisome?仿制藥的困難源于該產品復雜的物理結構。AmBisome?中的脂質成分由氫化大豆磷脂酰膽堿(HSPC)、二硬脂酰磷脂酰甘油(DSPG)、膽固醇和α-生育酚(一種防止脂質降解的抗氧化劑)組成。在AmBisome?中,AmpB帶正電的胺基與帶負電的DSPG相互作用形成穩定的離子絡合物。同時,與AmpB結合的膽固醇有助于將藥物保留在脂質雙分子層內,從而穩定制劑。這種獨特的超分子結構使AmBisome?具有低毒性和在體循環中的高穩定性,直到脂質體到達目標真菌細胞。AmBisome?的制備過程決定了脂質體的物理結構,如果不能復制AmBisome?的精確結構,將導致藥物在體內和體外釋放更快,毒性更高。一些AmBisome?仿制藥已在美國境外獲批,但一些仿制藥已被撤出市場,因為盡管具有相同的化學成分,但毒性遠遠超過AmBisome?,即Anfogen?(基因制藥,阿根廷)和Lambin?(太陽醫藥工業有限公司,印度)。AmBisome?及其仿制藥Anfogen?和Lambin?的毒性特征存在巨大差異,這表明確保不同產品和批次內的質量均勻性至關重要。
證明仿制藥的治療等效性始終是一個巨大的挑戰,尤其是脂質體制劑。由于AmBisome?獨特的超分子結構特征,僅展現定性(Q1)/定量(Q2)的相似性不足以確保仿制藥與原研藥的生物等效性。2016年,FDA起草了仿制藥AmpB脂質體開發指南,建議仿制藥和參比藥具有相同的藥物組成和相同的脂質體特征,包括脂質體組成、脂質體粒徑分布、層數、表面電荷、脂質雙層相變和體外釋放率。因此,有必要建立系統的分析方法,它不僅可以用于比較AmBisome?與其仿制藥之間的相似性,還可以為仿制藥開發過程中的處方和工藝優化提供建議。
在本文,我們選擇了AmBisome?的在印度上市的兩種現有仿制藥Phosome?和Amphonex?,對粒徑分布、組分定量、吸熱行為和體外藥物釋放行為進行了一系列表征實驗。我們還研究了不同制劑中的AmpB聚集狀態,因為聚集被認為是AmpB毒性的原因。基于這些發現,我們進一步研究了AmpB制劑對白色念珠菌的體外毒性和抗真菌活性。 我們在研究中納入了另外兩種AmpB產品,即FDA批準的Fungizone?和由ZoneOne制藥(批號35:48-7)制備的“泄漏”AmpB脂質體,這些產品與AmBisome ?有根本差異,以顯示我們方法的鑒別能力。Fungizone?是一種基于膠束的兩性霉素B制劑,缺乏脂質和膽固醇,但含有大量脫氧膽酸鈉作為增溶劑。AmpB脂質體(35:48-7)含有與AmBisome?相同的化學成分,但使用不同的生產工藝。我們試將這兩種產品的聚集狀態和藥物釋放行為與AmBisome?進行比較,以強調建立一套標準分析方法來評估AmpB產品均勻性的重要性。
2.1材料
四批AmBisome?(Astellas Pharma US, Inc.)和一批ApmB注射液Fungizone?(X-GEN Pharmaceuticals, Inc.)購自密歇根大學醫院藥房。四個批次的Phoso?(Cipla Ltd.)和三個批次的Amphonex?(Bharat Serums and Vaccines Ltd.)由BSV生物科學公司提供。泄漏的兩性霉素B脂質體(批號35:48-7)由ZoneOne Pharma Inc.制備。AmpB標準品購自美國藥典。氫化大豆磷脂酰膽堿(HSPC,純度99.8%)和1,2-二硬脂酰- Sn-甘油- 3 -磷酸甘油,鈉鹽(DSPG-Na,純度99.3%)購自NOF America Corporation。膽固醇(純度99%)和α -生育酚(純度96%)購自西格瑪。Floort-A-Lyzer ?透析管(截留分子量300 kDa)購自Spectrum Laboratories。Wistar大鼠全血購自創新研究公司。白色念珠菌(ATCC 10231)來自ATCC?。其他試劑來自商業來源。
2.2 粒徑分布和zeta電位
所有凍干AmpB制劑按照AmBisome?包裝說明書中的描述進行復溶,方法是在每個小瓶中加入12 mL去離子水,用力搖動小瓶30秒以完全分散脂質體,然后讓小瓶靜置得到含有4 mg/mL AmpB的混懸液。
粒徑檢測:將0.1 mL AmpB脂質體加入0.9 mL去離子水中,并使用Malvern ZetaSizer NanoZSP(Malvern Panalytical Ltd.)通過動態光散射檢測AmpB脂質體的粒徑分布。還使用Malvern ZetaSizer NanoZSP和DTS1070一次性折疊毛細管細胞(施加的場強為24.4V/cm)檢測了脂質體的Zeta電位。為測定顆粒濃度,用去離子水將AmpB脂質體稀釋100000倍注入Nanosight NS300(Malvern Panalytical Ltd.)。使用納米顆粒跟蹤分析(NTA)軟件對脂質體進行單獨跟蹤和記錄,并測量其顆粒粒徑和濃度。
2.3 AmpB和脂質定量
使用高效液相色譜法(HPLC,Waters 2695系統)在390 nm下進行紫外檢測(Waters 2996光電二極管陣列檢測器)對AmpB進行定量。將0.1 mL AmpB制劑溶于1 mL二甲基亞砜(DMSO)中,然后用甲醇稀釋至5 mL。將AmpB標準品溶于 DMSO配制成4mg/ml,然后用甲醇稀釋生成標準曲線。流動相包括(A)甲醇和(B)去離子水(均含0.1%三氟乙酸)。流速為1ml/min,梯度洗脫程序從60%(A)至84%(A)(9min),回到60%(A)(1min)。使用希金斯PROTO 300 C18色譜柱(5μm,250 ×4.6mm,柱溫為室溫)分析樣品,每次進樣的運行時間為13min。
使用超高效液相色譜-質譜法(UPLC-MS,Waters Acquity系統)檢測HSPC、DSPG和β -生育酚的含量。脂質體制劑在甲醇中分別稀釋100倍和2000倍。100倍稀釋樣品用于α -生育酚定量,2000 倍稀釋樣品用于HSPC和DSPG定量。流動相包括(A)含0.1%甲酸的去離子水、(B)含0.1%甲酸的乙腈、(C)含0.1%甲酸的甲醇和(D)100 mM甲酸銨水溶液。流速為0.3 mL/min,按照表1列出的梯度洗脫程序進行洗脫。色譜柱為Waters ACQUITY UPLC BEH 300 C4 (1.7 μm, 2.1 × 150 mm,柱溫為室溫),HSPC、DSPG - Na和α-生育酚的QDa質量檢測分別為784.69(+)、801.48(+)和431.64 (+)。
表1.使用UPLC-MS進行脂質定量的流動相組成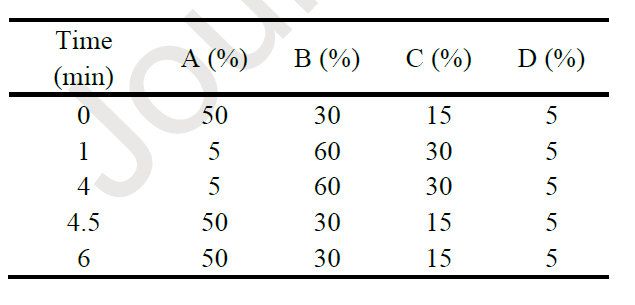
通過游離膽固醇檢測試劑盒(Wako Diagnostics)測定膽固醇濃度。用1% TritonX-100將AmpB脂質體稀釋50倍。用1% TritonX-100稀釋膽固醇標準品,生成標準曲線。將40 μL標準品或50 倍稀釋樣品在96孔板中與200 μL游離膽固醇顏色試劑混合。37°C孵育5分鐘后,將板冷卻至室溫,使用SpectraMax M3平板閱讀器(Molecular Devices)測量600 nm處的吸光度。
2.4 熱分析
采用差示掃描量熱法(DSC、Discovery DSC、TA儀器)分析,以評價不同AmpB制劑及其單個脂質體組分的吸熱行為。簡言之,將約5mg凍干AmpB制劑、AmpB標準品、HSPC、DSPG-Na和膽固醇單獨密封在鋁盤中,在50 mL/min的動態氮氣氛中以10°C/min的速率從25°C加熱到250°C。用空鋁盤作為基準盤進行校準。
2.5 AmpB聚集狀態研究
通過測量AmpB的紫外吸收光譜評價各制劑中AmpB的聚集狀態。用去離子水將所有制劑稀釋至50μg/ml和1μg/ml。同時,將AmpB標準品溶于DMSO配制成4mg/ml,用去離子水或甲醇稀釋至50μg/ml和1μg/ml,以生成兩種標準品:低聚物(AmpB溶于水)和單體(AmpB溶于甲醇)。所有樣品的紫外吸收光譜均使用SpectraMax M3平板閱讀器(Molecular Devices)獲取,掃描范圍為300 nm至440 nm,掃描步長為0.5 nm,在室溫下進行測量。
對于圓二色譜掃描,用去離子水將所有制劑稀釋至50μg/ml。將AmpB標準品溶于DMSO配制成4mg/ml,用去離子水或甲醇稀釋至50μg/ml。使用1mm比色皿在Jasco J - 815光譜儀上進行815掃描。在室溫下以100 nm/min的掃描速率記錄掃描,數據間隔為0.5nm。
2.6 體外藥物釋放
使用我們先前開發的方法,在USP-4儀器(推薦使用華溶DS-7CP流池法溶出系統)上進行不同制劑的體外藥物釋放。釋放介質為含5%蔗糖、0.01%疊氮化鈉和5% γ-環糊精的10 mM HEPES(pH 7.4)。將所有AmpB制劑用釋放介質稀釋至0.5 mg/mL,并立即將1.6 mL稀釋后的溶液置于透析裝置中。然后將透析裝置插入USP-4流通池中,每個池體釋放介質為78.4 mL,以獲得10μg/ml的最終AmpB濃度。介質以閉環方式灌注,流速為16 mL/min,溫度為55℃。同時,將等量游離藥物(10μg/ml)作為100%釋放對照品直接置于釋放介質中。采用在線紫外吸收法,在414 nm波長下,每小時檢測一次AmpB的釋放量。通過將供試品制劑中釋放的AmpB吸光度除以各時間點100%釋放對照品中釋放的AmpB吸光度,計算累積釋放(%)。AmBisome?與其他制劑的相似度采用f2檢驗,公式如下:
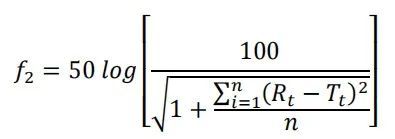
式中,n為時間點數量,Rt為參考批次在時間點t的累積釋放度(%),Tt為檢測批次在同一時間點的累積釋放度(%)。所有24個時間點的數據均用于f2計算,并且f2≥50認為與參比批次相似。
2.7 體外毒性評價
通過測定紅細胞溶血率(通過測定破裂RBC的鉀釋放量測定)評價體外毒性。取大鼠全血3000 g, 4℃離心12 min。收集紅細胞,用冷PBS緩沖液(147 mM氯化鈉、3mg氯化鉀、10mg磷酸氫二鈉,用鹽酸調節pH至7.4)洗滌兩次,并在使用前稀釋至原始全血體積。用5%葡萄糖將AmpB制劑稀釋至1000、500、100、50、20、10、5、2μg/ml。通過用5%葡萄糖將4mg/ml AmpB DMSO溶液稀釋至上述相同濃度制備游離藥物樣品(對于游離藥物和Fungizone?組,我們還添加了1μg/ml和0.5μg/ml)。對于各稀釋制劑,將200 μL樣品與900 μL 紅細胞混懸液和900 μL PBS緩沖液混合。將200 μL 5%葡萄糖與900 μL紅細胞混懸液和900 μL PBS緩沖液混合,制成陰性對照(0%鉀釋放),陰性對照中添加20 μM 纈氨霉素制成陽性對照(100%鉀釋放)。在37°C下孵育12h后,將樣品750 g離心10 min,并將上清液轉移至潔凈小瓶中。使用鉀離子選擇性電極(Thermo Sciences)測量各樣品的鉀濃度。通過以下公式(C,鉀濃度)計算各樣品的溶血率: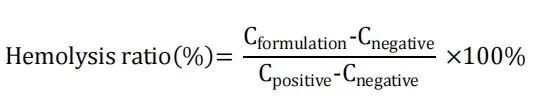
最后,計算每種制劑的紅細胞釋放50%鉀的濃度(K50)。
2.8 體外抗真菌活性實驗
將白色念珠菌在25℃的酵母霉菌培養液中培養。在抗真菌活性研究之前,將酵母在35℃的沙氏葡萄糖瓊脂中傳代培養24小時,然后用RPMI-1640稀釋至1~5×103 CFU/mL(加入谷氨酰胺,不含碳酸氫鹽,用0.165M的啉丙烷磺酸緩沖至pH7.0),所有AmpB制劑均用RPMI-1640稀釋至32 μg/mL。對于游離藥物組,首先將AmpB溶于DMSO配制成1.6 mg/ml,再用RPMI - 1640稀釋至32μg/mL。 采用微量肉湯稀釋法測定不同AmpB制劑對真菌池的最低抑菌濃度(MIC)。在96孔板中,以32 μg/μL濃度的AmpB制劑100 μL,依次1:2稀釋至每孔50 μL AmpB制劑。接下來取50 μL稀釋的酵母(1~5 × 103 CFU/mL),每孔酵母終濃度為0.5~2.5×103 CFU/mL,每孔AmpB終濃度分別為16、8、4、2、1、0.5、0.25、0.125、0.625、0.03125 μg/mL。無藥對照為50 μL RPMI-1640 + 50 μL酵母,空白為100 μL RPMI-1640。所有條件一式三份。在35°C下孵育24h后,向各孔中加入10μL alarma blue試劑(ThermoFisher),然后在37°C下孵育4h。微孔紅色說明真菌生長/存在,而藍色為真菌陰性。將MIC確定為出現藍色的最低藥物濃度。
2.9 統計分析
所有數據均以平均值±標準差表示。采用單因素方差分析(ANOVA)進行統計學比較。
3.1 粒徑分布和Zate電位
我們使用動態光散射(DLS)和納米粒子跟蹤分析(NTA)來確定每種制劑的粒徑分布。所有脂質體制劑尺寸都在100 nm左右,多分散指數約為0.2(表2,圖1A),由于含有磷脂組分,表面電荷為負(表2)。Amphonex?和AmpB脂質體-35:48-7的負電荷小于AmBisome?。膠束制劑Fungizone?遠小于脂質體制劑,約為20 nm(表2,圖1A)。通過NTA分析時,所有脂質體制劑的平均直徑略大于DLS測定值,但在所有制劑中保持相似。NTA還被用來定量各制劑中的顆粒濃度。總體而言,AmBisome?及其仿制產品中的顆粒濃度約為1-1.5×109顆粒/mL,但一批AmBisome?和一批Amphonex?的顆粒濃度較高。然而,相對于AmBisome?,脂質體AmpB制劑35:48-7顯示了顆粒濃度的顯著差異(表2,圖1B)。在脂質體制造的生產工藝中,通常使用擠出或均質法降低顆粒尺寸并改善均勻度。雖然這三種上市產品的生產工藝仍然是商業秘密,但我們知道35:48-7是通過7個均質化周期生產的。我們假設均質化誘導的物理應力可能破壞脂質體,導致觀察到的35:48-7相對較低的顆粒濃度。
表2.通過DLS和NTA系統檢測到的不同脂質體AmpB制劑的粒徑分布和zeta電位結果。數據表示為平均值± SD(n=3)。
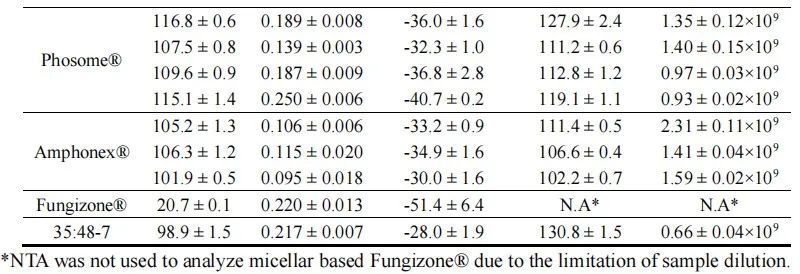
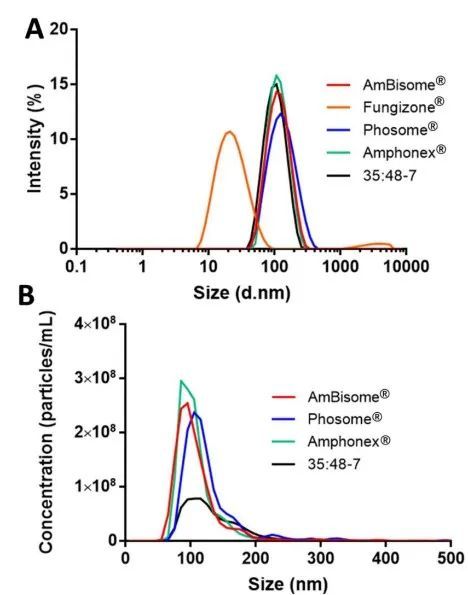 圖1.通過DLS(A)和NTA系統(B)檢測到的不同AmpB制劑的粒徑分布圖。
圖1.通過DLS(A)和NTA系統(B)檢測到的不同AmpB制劑的粒徑分布圖。
3.2 AmpB和脂質組分的定量
建立了幾種定量測定不同制劑中AmpB及其他脂質成分的方法。根據包裝說明書,每瓶AmBisome?含有50mg兩性霉素B,插入到由約213 mg HSPC、52 mg 膽固醇、84 mg DSPG和0.64 mg α-生育酚組成的脂質體膜中。AmBisome?復溶操作后的AmpB濃度為4mg/ml;因此,我們基于4mg/ml 的AmpB計算了所有其他成分的濃度。對多批產品進行定量分析。AmBisome?所有批次中測定的AmpB濃度比報告的濃度高3-10%,而在Phosome?和Amphonex?中測得的AmpB濃度約低10%。對于脂質,AmBisome?中的HSPC濃度比報告的濃度高5-10%,AmBisome?中檢測到的DSPG和膽固醇濃度與報告的相似。且在Amphonex?中檢測到的脂質濃度與報告值相似,而Phosome?的所有脂質濃度均較低。AmBisome?和Amphonex?中α-生育酚的濃度都略高于報告濃度(見表3)。這些定量方法的驗證見補充數據。
表3.不同AmpB制劑的組分定量。
Fungizone?是由脫氧膽酸鈉溶解的兩性霉素B的注射用AmpB制劑,不含脂質成分。數據表示為平均值± SD(n=3)。
3.3 熱分析
對于Fungizone?,在AmpB標準品中觀察到的在120℃和206℃左右的兩個吸熱峰變為約85°C和170°C(圖2B),與先前的文獻報道一致。由于Fungizone?是一種凍干產品,結晶AmpB可能導致吸熱峰偏移。對于AmBisome?、Phosome?和Amphonex?,差示掃描量熱圖均相似,僅在210 ℃附近有一個明顯的吸熱峰,這意味著AmpB被完全裝載到脂質體中。在所有三個樣品中均觀察到60 °C左右的小峰,可能與HSPC和DSPG的存在相關(圖2C)。對于35:48-7,在178°C附近也觀察到另一個小峰。 圖2 不同脂質體AmpB制劑(A)、AmpB標準品和Fungizone? (B)、和主要脂質組分(C)的DSC圖
3.4 AmpB聚集狀態
由于內酯環的分子結構,AmpB具有兩親性。它可以通過與相鄰的多烯鏈相互作用自締合和聚集。因為AmpB的聚集狀態被認為與AmpB的活性和毒性相關,所以AmpB的聚集狀態很重要。AmpB在水中以低濃度保持單體狀態,但當濃度增加時進入低聚狀態(也稱為可溶性聚集體)。據報道,AmpB的聚集狀態很容易通過分光光度法區分。在本研究中,AmpB溶于甲醇和水被作為對照。在高濃度(50μg/ml)下,甲醇中的AmpB顯示出典型的單體狀態光譜,在363nm、383nm和406nm附近有三個吸收峰。水中的AmpB在328-349nm處顯示出單一寬帶,這是低聚態光譜的典型特征(圖3A)。在低濃度(1μg/ml)下,甲醇中的AmpB仍保持其單體狀態,而水中的AmpB明顯從低聚物轉變為單體;在長波長處,這三個峰的強度顯著增加,328-349nm峰消失(圖3B)。先前,研究人員使用第一個峰(328-349nm)與第四個峰(406nm)的比值監測AmpB的聚集狀態。根據吸收光譜的形狀,單體AmpB的該比值將非常低,低聚AmpB的該比值將越來越高。在我們的研究中,在50μg/ml水和甲醇中,AmpB的峰1與峰4的比值分別為4.37和0.28,在1μg/ml水和甲醇中,AmpB的峰1與峰4的比值分別為0.63和0.16。
所有市售水溶液制劑(AmBisome?、Phosome?、Amphonex?和Fungizone?)中的AmpB似乎處于低聚狀態(50μg/ml)(圖3A)。每一種制劑的峰1和峰4的比值在5-6之間。然而,一些制劑在1μg/mL AmpB時顯示出不同的聚集狀態。AmBisome?、Phosome?和Amphonex?在該低濃度下保持低聚狀態,并且這三種脂質體制劑的峰1與峰4的比值幾乎等于50μg/mL時的比值(圖3)。在各制劑的多個批次中未觀察到AmpB聚集狀態的顯著差異(圖S1)。Fungizone?在1μg/mL AmpB下轉變為單體狀態,與在水中觀察到的AmpB相似,并在5.6-0.65之間顯示出峰1與峰4比值的顯著變化(圖3B)。聚集狀態的差異可能是由于脂質體中存在DSPG和膽固醇。AmpB和DSPG可結合形成穩定的離子絡合物,膽固醇在脂質體雙層使藥物包封穩定。因此,脂質體中AmpB與脂質雙層之間的相互作用可能有助于在低濃度下維持低聚物狀態。
Phosome?和Amphonex?的吸收光譜與AmBisome?相似,但在兩種AmpB濃度下,35:48-7的吸收光譜與AmBisome?不同。與在320-330nm處具有單一寬峰的AmBisome?光譜不同,35:48-7光譜在350nm處具有肩峰,并且在363nm、383nm和410nm處具有單體AmpB特征的多個獨特峰。盡管35:48-7的AmpB濃度與AmBisome?相似(表3),但顆粒濃度顯著降低(圖1B)。根據我們的結果,我們假設高應力均勻化過程損害了一些脂質體。35:48-7熱分析和聚集狀態表征的結果進一步支持了這一假設,因為178℃下DSC熱譜圖中存在異常吸熱峰(圖2A),紫外光譜中存在單體AmpB特征峰(圖3),說明存在泄漏的AmpB。
除紫外吸收外,圓二色譜(CD)是另一種用于AmpB聚集狀態研究的技術。水性介質中AmpB聚集體(低聚物)的代表性CD光譜顯示,以約340 nm處為中心的不對稱偶聯,最大值和最小值分別為328和350 nm處。我們還對不同的AmpB制劑進行了CD分析(圖S2)。水中的AmpB(圖S2A)顯示了典型的低聚CD光譜,而甲醇中的AmpB(圖S2B)顯示了由于單體狀態導致的完全不同的CD光譜。所有脂質體制劑(AmBisome?、Phosome?和Amphonex?)均顯示相似的CD光譜(圖S2C),Fungizone?(圖S2D)和脂質體制劑均顯示具有典型寡聚特征的CD光譜。然而,當我們疊加CD譜時,所有公式中的橢圓率值完全不同(圖S2E)。這是因為每種制劑的介質中的成分不同,介質環境可能會強烈影響CD儀器的響應。難以保持介質相同,也難以比較多種制劑之間的CD光譜相似性。然而,通過CD掃描,我們確實觀察到了AmBisome?、Phosome?和Amphonex?之間的相似性,并證實了所有水性制劑中存在低聚態。
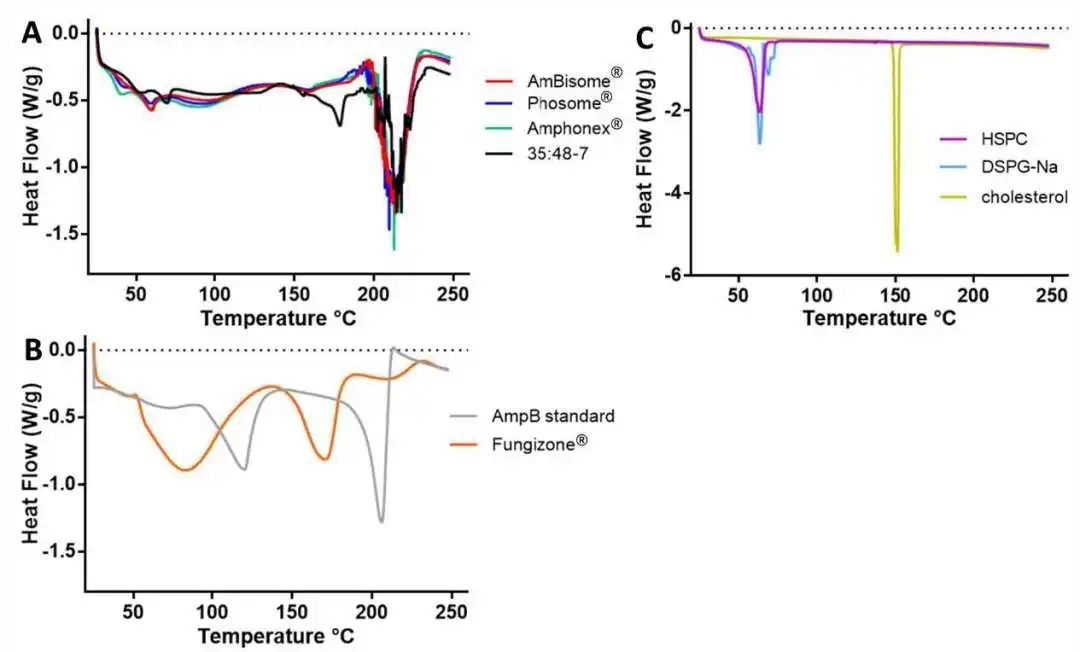
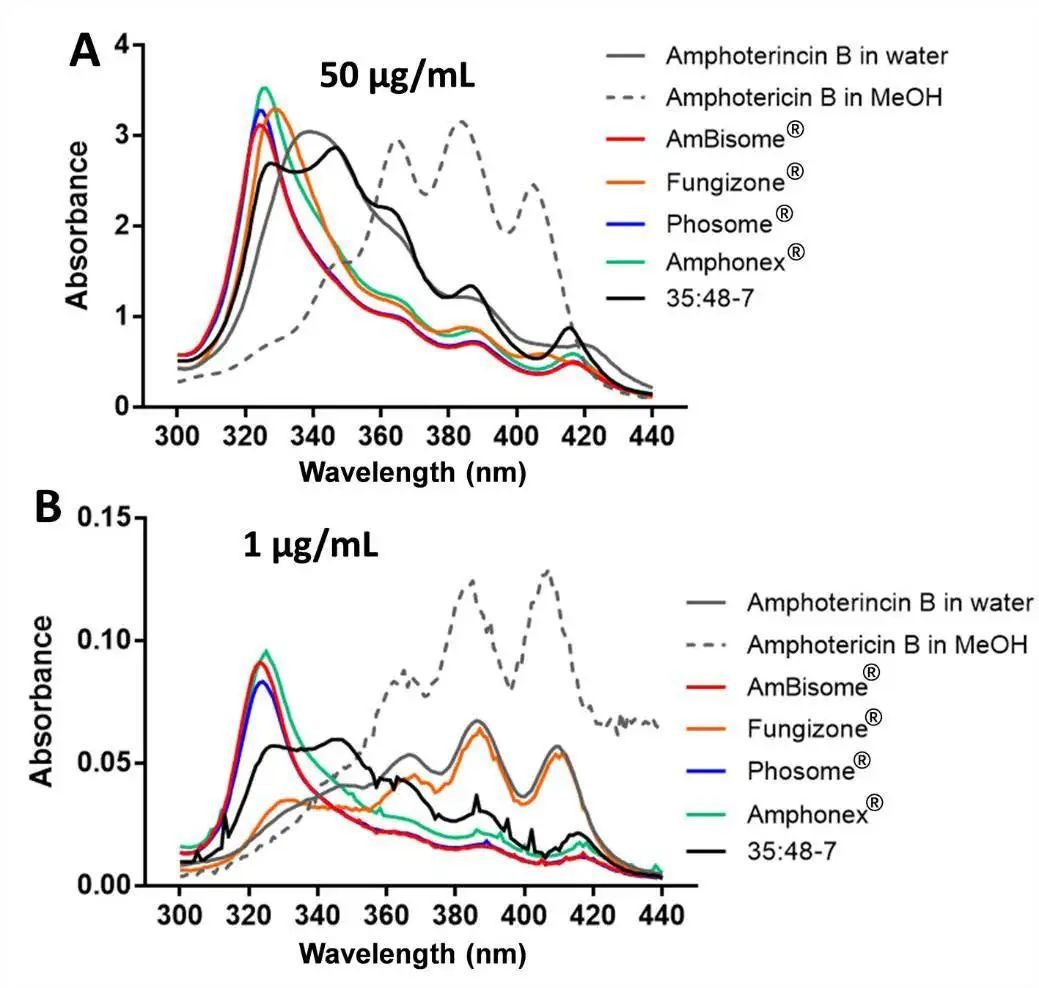
圖3. 50μg/ml(A)和1μg/ml(B)不同AmpB制劑的吸收光譜與水和甲醇中的AmpB相比。
3.5 體外藥物釋放
我們使用我們先前建立的AmpB脂質體的USP 4流池裝置藥物釋放試驗來比較不同的AmpB制劑。Amphonex?的釋放曲線與AmBisome?幾乎相同,f2值約為85(圖4)。Phosome?的藥物釋放略慢于AmBisome?,f2值為65。認為Amphonex?和Phosome?的釋放行為與AmBisome?相似,f2值大于50。與AmBisome?相比,膠束制劑Fungizone?的藥物釋放顯著更快,f2值約為17,6h內釋放出近90%的藥物。35:48-7也顯示出比AmBisome?更快的藥物釋放,f2值為37。各制劑的多個批次之間的釋放曲線無顯著差異(圖S3)。
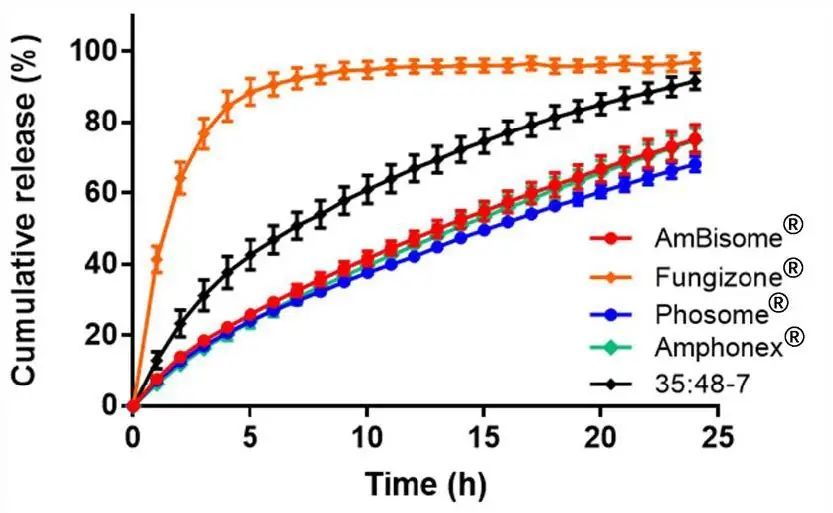
圖4.不同AmpB制劑的累積釋放曲線。數據表示為平均值± SD(n=3)。
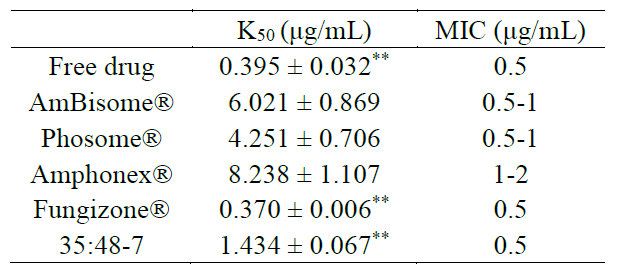
3.6 體外毒性進行了紅細胞溶血研究,以確定AmpB脂質體的體外毒性。基于溶血紅細胞釋放的鉀量計算溶血率。三種上市藥物之間或每種制劑的多個批次之間的毒性無顯著差異(圖5、圖S4)。計算的Amphonex? 的K50(導致50%鉀釋放的AmpB濃度)略高于AmBisome?,但在溶血曲線中未觀察到顯著差異。與脂質體制劑相比,游離藥物和Fungizone?顯示出更高的毒性和顯著更低的K50值(圖5,表4)。當AmBisome?上市時,它聲稱其毒性降低是相對于其他現有治療的最大改善。AmBisome?中存在的脂質(包括HSPC和DSPG)具有相對較高的轉變溫度,增強了37°C下的脂質體穩定性以延長循環時間。AmpB與DSPG/膽固醇之間的結合還通過形成在體內顯示最小毒性的剛性AmpB脂質體增加穩定性。因此,我們認為完整的脂質體結構對降低毒性非常重要。我們認為35:48-7是脂質體和游離AmpB的混合物,與AmBisome?相比表現出更大的毒性(圖5,表4),與更快的藥物釋放一致(圖4)。
進行了紅細胞溶血研究,以確定AmpB脂質體的體外毒性。基于溶血紅細胞釋放的鉀量計算溶血率。三種上市藥物之間或每種制劑的多個批次之間的毒性無顯著差異(圖5、圖S4)。計算的Amphonex? 的K50(導致50%鉀釋放的AmpB濃度)略高于AmBisome?,但在溶血曲線中未觀察到顯著差異。與脂質體制劑相比,游離藥物和Fungizone?顯示出更高的毒性和顯著更低的K50值(圖5,表4)。當AmBisome?上市時,它聲稱其毒性降低是相對于其他現有治療的最大改善。AmBisome?中存在的脂質(包括HSPC和DSPG)具有相對較高的轉變溫度,增強了37°C下的脂質體穩定性以延長循環時間。AmpB與DSPG/膽固醇之間的結合還通過形成在體內顯示最小毒性的剛性AmpB脂質體增加穩定性。因此,我們認為完整的脂質體結構對降低毒性非常重要。我們認為35:48-7是脂質體和游離AmpB的混合物,與AmBisome?相比表現出更大的毒性(圖5,表4),與更快的藥物釋放一致(圖4)。
表4.體外毒性和抗真菌活性結果。不同AmpB制劑的K50值,表示為平均值±SD(n=3)。* *表示與AmBisome ?相比,p值小于0.01。不同AmpB制劑對白色念珠菌的最小抑制濃度,顯示為三倍結果范圍。
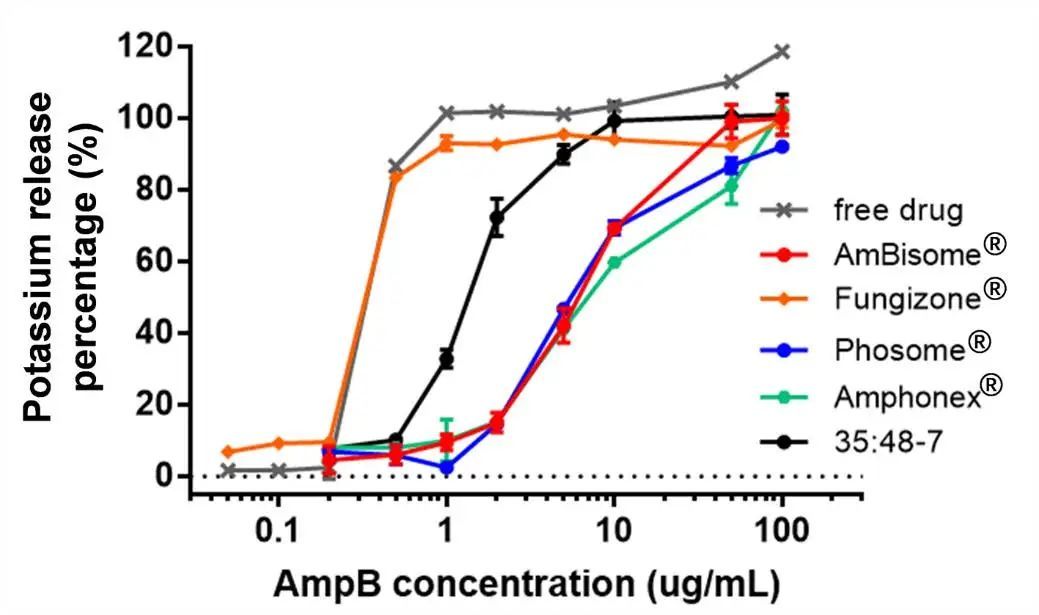
圖5.隨著不同AmpB制劑濃度的增加,在37°C下孵育12h后測定大鼠紅細胞中的鉀釋放。數據表示為平均值± SD(n=3)。
3.7 體外抗真菌活性
根據臨床和實驗室標準研究所M27-A2參考方法的微量肉湯稀釋法進行抗真菌研究。盡管不同制劑的紅細胞毒性不同,但所有制劑對白色念珠菌的抗真菌作用相似(圖6)。除Amphonex?的MIC稍高外,其他制劑的最小抑制濃度(MIC)大致為0.5μg/mL AmpB,(見表4)。
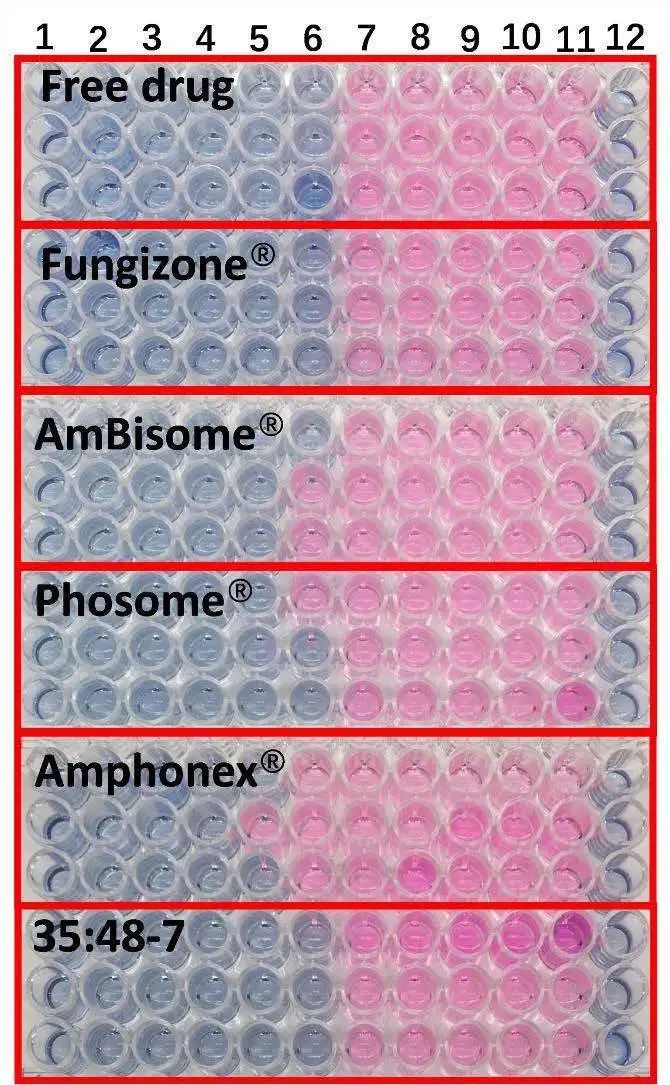
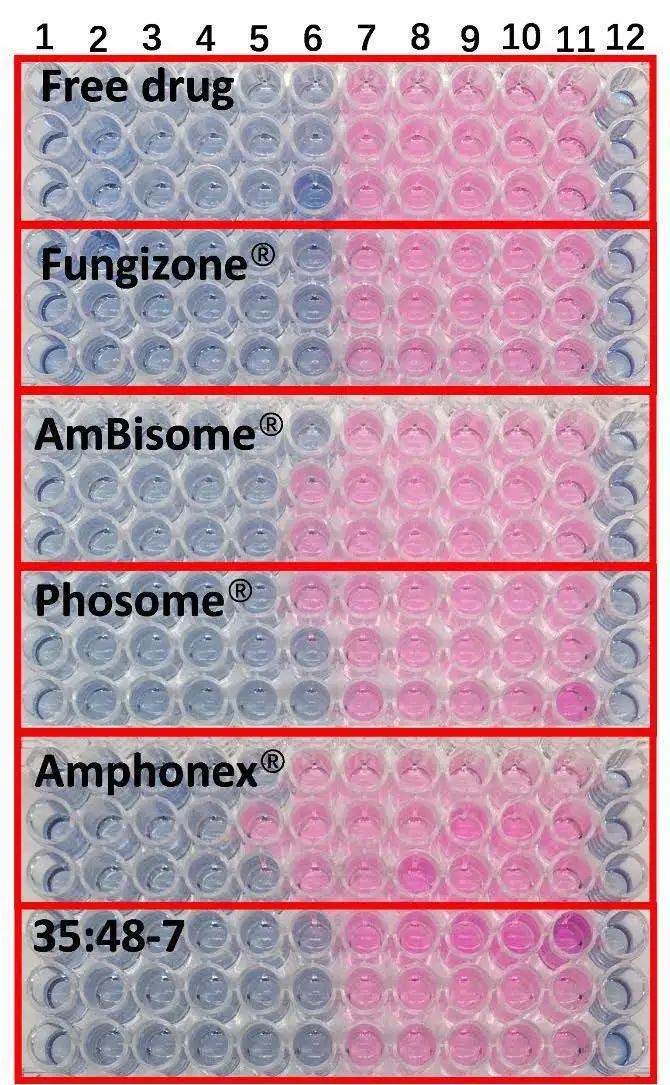
圖6.不同AmpB制劑對白色念珠菌的抗真菌活性。1-10號孔的藥物濃度分別為16、8、4、2、1、0.5、0.25、0.125、0.0625和0.03125 μg/ml。11號孔含有無藥物對照品,12號孔為空白(n=3)。
迄今為止,有三種經FDA批準的AmpB制劑上市:AmpB注射液(常規注射液,X-GEN Pharmaceuticals, Inc.),AmBisome?(脂質體注射液,Astellas Pharma US, Inc.)和Abelcet?(脂質復合物注射液,Leadiant BioSciences, Inc.)。AmBisome?是美國唯一的AmpB脂質體產品。AmBisome?的幾種仿制藥在其他國家上市,包括Phosome?((Cipla Ltd.)、Amphonex?(Bharat Serums and Vaccines Ltd.)和AmBiL?(臺灣脂質體有限公司)。盡管Phosome?和Amphonex?的組成與AmBisome?相同,但我們觀察到這些產品之間存在一些差異。Amphonex?的AmpB濃度比AmBisome?低10%,四個批次Phosome?中所有組分的濃度均低于AmBisome?。盡管成分組量不同,Phosome?和Amphonex?在理化性質、藥物釋放、體外毒性和抗真菌方面與 AmBisome?相似。
由于AmBisome?在2016年失去了美國專利保護,制藥行業對開發AmpB脂質體仿制藥非常感興趣。但FDA尚未批準AmBisome?的仿制藥。這可能是由于在開發產生與參比產品具有相似質量、療效和安全性特征的仿制產品的生產工藝方面存在技術困難。對于胃腸外納米顆粒產品,了解生產工藝如何影響納米顆粒超分子結構,產品性能始終復雜。在AmBisome?中,AmpB與脂質雙層相關,生產工藝參數的輕微變化可能會改變脂質體中的藥物分布狀態,并導致產品質量差異。同時,AmpB的低溶解度和脂質組分的高轉變溫度要求在生產過程中進行關鍵酸化步驟和嚴格的溫度控制。所有這些障礙使得仿制AmBisome?的開發成為一個巨大挑戰。
缺乏標準分析方法也是仿制AmBisome?開發的一個障礙。由于獨特的超分子結構,很難建立胃腸外納米顆粒藥品表征的通用標準指南。FDA為仿制藥開發起草了多份產品特定指南。在本研究中,我們嘗試建立符合FDA指南的脂質體AmpB分析方法。我們已建立了AmpB以及每種脂質組分的定量方法。我們還建立了脂質體粒徑分布和表面電荷分析的DLS和NTA方法、脂質雙層相變的DSC分析以及體外藥物釋放的USP-4裝置釋放試驗。在FDA指南中,我們缺失的唯一推薦研究是脂質體中層數的評估,可通過透射電子顯微鏡(TEM)、磁共振或小角X射線散射(SAXS)進行。本研究主要關注AmpB脂質體的體外理化特性。為了全面評價這些產品,需要進行體內研究,比較不同制劑的藥代動力學和安全性指標。
AmpB的使用因其劑量依賴性急性和慢性毒性而受到高度限制。幾項比較AmpB制劑的研究顯示,AmBisome腎毒性降低,但AmpB -脂質復合物的毒性與常規AmpB注射幾乎相似,表明脂質體結構對降低毒性至關重要。AmBisome?具有完整的脂質體結構,在循環穩定性方面優于競爭對手。脂質組分的高轉變溫度以及兩性霉素B和脂質雙層之間的強烈關聯有助于延長AmBisome?的循環時間、增強穩定性和降低體內毒性。在Olson等人的兩項研究中,比較了脂質體AmpB產品的毒性,雖然它們的化學成分相同,但Anfgen?和Lambin?的毒性是AmBisome?毒性的5-10倍。因此,生產差異可能解釋了這些不同的毒性。
在本文中,我們的結果與理論一致。AmpB脂質體35:48-7采用高壓均質工藝生產,其組成與AmBisome?完全相同。雖然35:48-7中檢測到的AmpB濃度與AmBisome?中的濃度相似,但通過NTA測量的35:48-7的顆粒濃度遠低于AmBisome?中的濃度(表2)。我們假設幾個高壓均質循環的機械力破壞了脂質體結構,從而從脂質體中釋放出一些AmpB,并導致AmpB聚集狀態的顯著差異(圖3)。與AmBisome?相比,35:48-7中游離AmpB的存在也可能誘導藥物更快的釋放(圖4)和更高的毒性(圖5)。因此,為了防止毒性增加,必須在整個生產工藝中保持脂質體AmpB的超分子結構。
在本研究中,我們建立了一系列用于表征AmpB脂質體的分析方法,包括粒徑分布、組分定量、熱分析、AmpB聚集狀態分析、藥物釋放測定、體外毒性分析和抗真菌效應評價。在這些表征研究中,將在印度上市的兩種仿制藥(Phosome?和Amphonex?)、一種膠束制劑(Fungizone?)和一批內部制備的AmpB脂質體(35:48-7)與AmBisome?進行比較。根據我們的結果,AmpB脂質體制劑Phosome?和Amphonex?與AmBisome ?相似,而膠束AmpB處方Fungizone?存在顯著差異。通過高壓均質法生產的35:48-7脂質體,在理化性質上表現出顯著差異,包括更快的藥物釋放和更高的毒性。我們認為,本研究中概述的系統方法將有助于優化仿制AmpB脂質體制劑的生產工藝,并確認仿制制劑與參比制劑之間的相似性。
略
如需原文,請聯系小編(代老師15012941165)