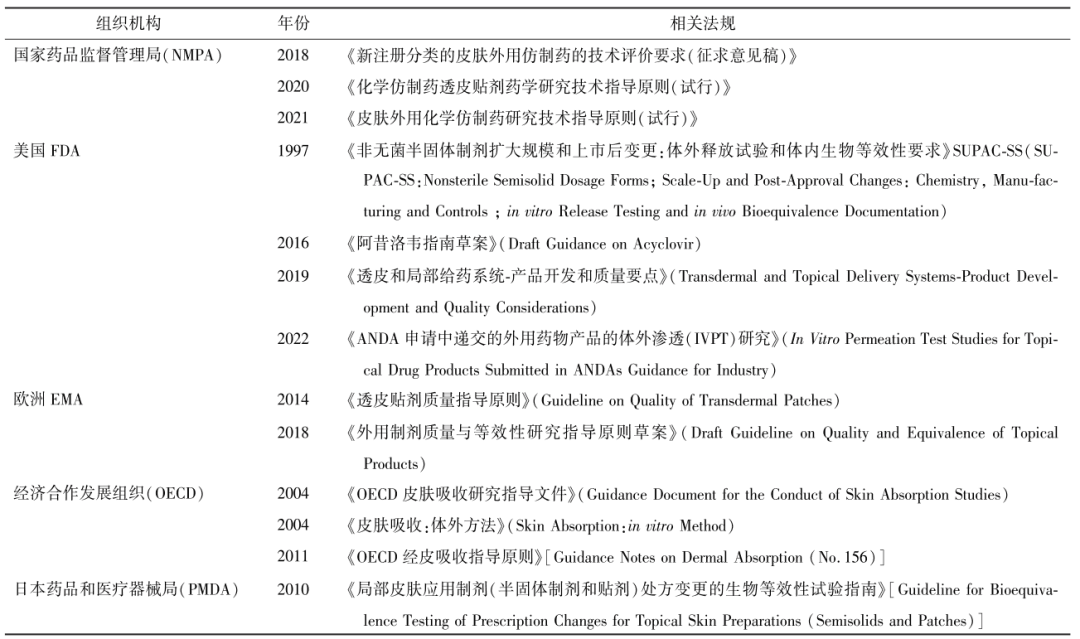
時(shí)間:

體外滲透試驗(yàn)(in vitro permeation test,IVPT) 作為最關(guān)鍵的體外研究項(xiàng)目之一,已被廣泛用于皮膚遞藥制劑的研發(fā)及其生物等效性(bioequivalency,BE)評(píng)價(jià)。IVPT通過模擬藥品在生理?xiàng)l件下的透皮過程,反映藥品的質(zhì)量與臨床治療的有效性,但在實(shí)際操作中存在皮膚難以獲得,皮膚受種屬、年齡、狀態(tài)、部位等多因素干擾的困難。為了完善規(guī)范IVPT,國內(nèi)外藥品監(jiān)管機(jī)構(gòu)已制定了不同的試驗(yàn)標(biāo)準(zhǔn)。因此,本文參考國內(nèi)外相關(guān)IVPT法規(guī),結(jié)合文獻(xiàn)研究內(nèi)容,對(duì)IVPT的關(guān)鍵設(shè)計(jì)因素進(jìn)行總結(jié)歸納,并補(bǔ)充了其作為評(píng)價(jià)手段的典型應(yīng)用以供業(yè)界人士參考。

皮膚遞藥制劑通過皮膚途徑給藥,根據(jù)療效可分為作用于皮膚局部起效的制劑和經(jīng)皮吸收進(jìn)入血液循環(huán)后起全身作用的制劑 。根據(jù)制劑劑型及組成形式,可以分為半固體制劑,包括軟膏劑、乳膏、凝膠劑等,以及全身或局部遞送的組合式經(jīng)皮給藥系統(tǒng),(transdermal and topical delivery systems,TDS)主要包括透皮貼劑和貼膏劑。
皮膚遞藥制劑作為一類復(fù)雜制劑,處方組成或生產(chǎn)工藝的變化可能會(huì)顯著影響藥物有效性和安全性。為了對(duì)皮膚遞藥制劑進(jìn)行更好質(zhì)量研究和評(píng)審,針對(duì)局部起效的復(fù)雜制劑,需確定皮膚內(nèi)制劑的藥物濃度并分析其對(duì)真皮深層組織的滲透行為,以便評(píng)估真皮層的生物利用度(bioavailability,BA)或不同制劑之間的生物等效性(bioequivalency,BE)。然而建立皮膚外用制劑的BE,大多需進(jìn)行臨床療效試驗(yàn),需要大量人力和物力,昂貴且耗時(shí) 。目前為止已開發(fā)了不同的體內(nèi)、體外測試方法用以證明局部外用制劑的BE。IVPT作為體外測試方法之一,通過評(píng)估皮膚外用局部制劑中藥物(即活性成分)到達(dá)皮膚作用部位或附近的速率和程度,可與BE體內(nèi)評(píng)估相關(guān)聯(lián)并進(jìn)行預(yù)測 ,在一定程度上表征和評(píng)估仿制藥與參比制劑中藥物的生物等效程度以及安全暴露程度。
為建立全身給藥經(jīng)皮制劑的BE,對(duì)于給藥后存在一定全身性吸收的藥物,可采用靜脈采血法研究經(jīng)皮給藥后的藥動(dòng)學(xué)生物等效性(PK-BE)。IVPT作為一項(xiàng)有效的評(píng)價(jià)方法,可用于評(píng)價(jià)皮膚遞藥制劑中藥物(即活性成分)經(jīng)皮滲透并進(jìn)入體內(nèi)的行為,模擬藥品在生理?xiàng)l件下的透皮過程,以部分地反映藥品的質(zhì)量與臨床治療的有效性,并在一定程度上預(yù)測藥物體內(nèi)吸收的過程,以及評(píng)估受試制劑與參比制劑的生物等效性差異。
IVPT主要利用人體或動(dòng)物的離體皮膚進(jìn)行實(shí)驗(yàn),模擬外用制劑在生理?xiàng)l件下的透皮過程,通過測量藥物透過皮膚的滲透速率和程度表征評(píng)估自研外用制劑與對(duì)照制劑中藥物的BA。早期為證明體外試驗(yàn)?zāi)P吞娲鶥E檢驗(yàn)的有效性,F(xiàn)ranz等通過試驗(yàn)有力支持了體外人體皮膚模型的相關(guān)性和預(yù)測能力。相較臨床終點(diǎn)研究,IVPT可使試驗(yàn)成本大大縮小,但在實(shí)際操作中存在皮膚難以獲得,皮膚受種屬、年齡、狀態(tài)、部位等多因素干擾,皮膚處理困難,方法可重現(xiàn)性差等困難因素,進(jìn)而影響結(jié)果的可靠性。為規(guī)范試驗(yàn)操作,各藥品監(jiān)管部門已發(fā)布相關(guān)指導(dǎo)原則(見表1),但至今仍沒有統(tǒng)一標(biāo)準(zhǔn),因此本文通過結(jié)合IVPT相關(guān)指南及國內(nèi)外研究文獻(xiàn),對(duì)涉及IVPT關(guān)鍵技術(shù)參數(shù)的影響因素進(jìn)行了歸納總結(jié),并補(bǔ)充了其作為評(píng)價(jià)手段的典型應(yīng)用。
2.1 皮膚類型
藥物的透皮速率高度依賴于皮膚的類型和質(zhì)量,離體人類皮膚被視為是最適合IVPT的模型(黃金標(biāo)準(zhǔn))。但由于涉及倫理問題,多數(shù)國家未建有人體皮膚銀行,皮膚通常難以獲取。另一方面由于性別、種族、年齡和供體解剖部位的差異也常導(dǎo)致試驗(yàn)標(biāo)準(zhǔn)化水平較低。研究表明,相對(duì)離體人體皮膚,豬和豚鼠作為皮膚滲透性研究的模型往往具有更少的樣本差異性 。目前各種哺乳動(dòng)物、嚙齒動(dòng)物和爬行動(dòng)物的動(dòng)物皮膚模型已被開發(fā)為人類皮膚的替代品,在IVPT中進(jìn)行廣泛研究。同時(shí)人造皮膚由于結(jié)構(gòu)和生理特征方面與人體皮膚相似,且不存在倫理問題,也已被開發(fā)為經(jīng)皮滲透模型 。針對(duì)IVPT不同動(dòng)物模型以及各種人造皮膚模型的優(yōu)勢及局限性可見表2和表3。


2.2 皮膚處理和儲(chǔ)存
不同個(gè)體以及人體不同部位皮膚由于角質(zhì)層厚度、脂類含量及組分的差異導(dǎo)致皮膚屏障功能不同,因此對(duì)藥物的透皮吸收能力不同。沈騰等采用Valia Chine擴(kuò)散池與HPLC法對(duì)比了男性和女性身體不同部位皮膚對(duì)川芎嗪滲透速率的差異,結(jié)果表明男性額頭、耳后、胸部等5個(gè)部位的經(jīng)皮滲透能力顯著高于女性,且額頭部位的皮膚對(duì)川芎嗪的滲透系數(shù)遠(yuǎn)高于對(duì)川芎嗪滲透速率最小的胸部皮膚。因此所有皮膚的使用來源以及皮膚供體中指定的解剖區(qū)域應(yīng)保持一致,同時(shí)應(yīng)排除有紋身等任何皮膚異常跡象或毛發(fā)濃密的皮膚。
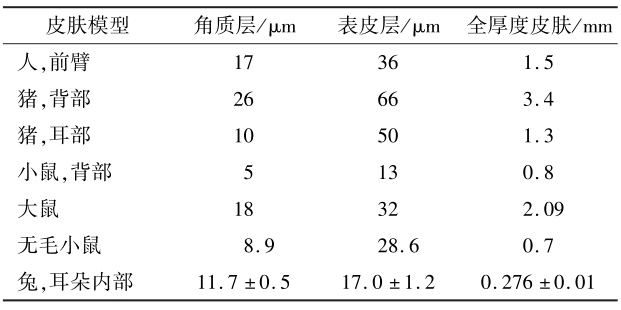
皮膚在處理過程中很大可能會(huì)影響藥物的經(jīng)皮滲透性和滯后時(shí)間 。處理皮膚時(shí),為避免破壞皮膚屏障,應(yīng)采用溫和的方式處理皮膚表面。為避免水合作用影響皮膚的滲透性,也不宜將皮膚浸泡在水溶液中。經(jīng)處理完的皮膚膜通常有3種類型:表皮膜(厚度約0.1mm,可通過熱分離、化學(xué)或酶法制備)、剝離一定厚度的皮膚(厚度為0.2~0.5mm)和全厚度皮膚(厚度為0.5~1.0mm)。全厚度皮膚通過去除結(jié)締組織和皮下脂肪制備,由包括真皮在內(nèi)的所有層組成,相對(duì)其他 2種類型的皮膚膜,皮刀控制全層皮膚的切割厚度在500~750μm,可減少測量值的變異性,適用于小鼠或兔等皮膚厚度較薄的動(dòng)物模型以及親水性化合物的體外研究 。但針對(duì)親脂性較強(qiáng)的化合物,由于其經(jīng)皮滲透性弱、滯后時(shí)間長,使用全厚皮膚可能會(huì)影響試驗(yàn)結(jié)果 。本文總結(jié)了IVPT中常用動(dòng)物皮膚模型相對(duì)于人的皮膚層厚度,如表4所示。
皮膚在儲(chǔ)存過程中,儲(chǔ)存條件可能會(huì)破壞皮膚的屏障完整性,進(jìn)而影響皮膚的滲透,因此最好使用新鮮切除的皮膚進(jìn)行實(shí)驗(yàn)。針對(duì)動(dòng)物皮膚模型,常采用新鮮處理過的皮膚,而新鮮離體人類皮膚不易獲得,在使用前常需在-20℃的條件下冷凍保存 。針對(duì)冷凍儲(chǔ)存對(duì)皮膚滲透性的具體影響,有研究發(fā)現(xiàn),新鮮皮膚和經(jīng)冷凍處理皮膚在透水性方面沒有差異 ,但經(jīng)冷凍的皮膚對(duì)其他化合物的滲透性增加,導(dǎo)致藥物經(jīng)皮滯后時(shí)間縮短 。然而Nicoli等發(fā)現(xiàn)經(jīng)冷凍處理的兔耳皮膚對(duì)雌二醇的滲透性低于新鮮兔耳皮,作者將此歸因于皮膚經(jīng)冷凍后酶活性增加,導(dǎo)致雌二醇在透過皮膚時(shí)發(fā)生了酶促分解。冷凍可能會(huì)改變表皮內(nèi)的細(xì)胞活力,因此不適用于研究藥物在皮膚中的代謝活性。目前各監(jiān)管機(jī)構(gòu)之間尚未就皮膚在使用前的冷凍時(shí)間達(dá)成共識(shí)。國際化學(xué)品安全規(guī)劃署(International Programme on Chemical Safety,IPCS)規(guī)定人體皮膚可以儲(chǔ)存1年,而美國環(huán)境保護(hù)署(U.S Environmental Protection Agency,EPA)只允許皮膚儲(chǔ)存3個(gè)月。同時(shí)皮膚經(jīng)冷凍儲(chǔ)存后,還需注意皮膚的解凍過程。與新鮮皮膚相比,冷凍皮膚未經(jīng)水化前,其皮膚滲透值可能會(huì)發(fā)生改變 ,因此在使用前應(yīng)適當(dāng)?shù)亟o其補(bǔ)充水分。
2.3 皮膚完整性檢查及供體數(shù)的確認(rèn)
無論選擇何種皮膚,在實(shí)驗(yàn)前后均需對(duì)皮膚的屏障完整性進(jìn)行測試,以鑒定研究中給藥的每個(gè)皮膚切片的有效性。針對(duì)皮膚屏障完整性測試方法,盡管還沒有相應(yīng)的藥典收載或法定可接受標(biāo)準(zhǔn),但目前常見的有3種方法,即經(jīng)皮水分散失法(trans-epidermal water loss,TEWL)、氚化水滲透法(tritiated water)和經(jīng)皮電阻法,(trans-epidermal electrical resist-ance,TEER)表5對(duì)3種測試皮膚屏障完整性的方法進(jìn)行了總結(jié)歸納。

TEWL通過測定皮膚外表面附近的水分(蒸汽),評(píng)估水分從皮膚下側(cè)通過皮膚屏障的速率評(píng)估皮膚的屏障完整性,因技術(shù)成熟、操作方便而被廣泛接受。但TEWL測量值常可能因TEWL測試設(shè)備、操作方式和環(huán)境條件的不同而變化。為了避免測試環(huán)境中的空氣流動(dòng)對(duì)測量值的影響,在測試設(shè)備上建議選擇封閉式腔室 。針對(duì)開放式腔室,則需要導(dǎo)流罩消除空氣流動(dòng)的影響 。關(guān)于TEWL用于評(píng)估皮膚屏障完整性的截止標(biāo)準(zhǔn), Zhang等在研究TEWL與模型藥物芬太尼透皮貼劑經(jīng)皮滲透之間的關(guān)系中指出,當(dāng)皮膚樣本數(shù)量較少時(shí),TEWL值為10g·m-2 ·h-1可作為屏障完整性的測試標(biāo)準(zhǔn)。美國FDA對(duì)TEWL測試的可接受標(biāo)準(zhǔn)則為15g·m-2 ·h-1 。
在氚化水滲透試驗(yàn)中,在擴(kuò)散池供體室中加入少量氚水,根據(jù)皮膚對(duì)氚化水的滲透性測試皮膚的完整性。早期根據(jù)Franz等 的研究,30min內(nèi)氚化水的經(jīng)皮滲透值超過1.6μL·cm-2的皮膚樣本則會(huì)被認(rèn)為屏障受損,不予使用。隨后根據(jù)其他實(shí)驗(yàn)室經(jīng)大量測試產(chǎn)生的結(jié)果分析,還提出了1.56和2.0μL·cm-2 。
TEER測試是通過在皮膚樣本上施加少量離子溶液測得的電阻值來表征通過皮膚的電流量。相比其他2種測試方法,TEER可快速評(píng)估皮膚的屏障完整性。關(guān)于測試皮膚屏障完整性的截止標(biāo)準(zhǔn),可通過試驗(yàn)數(shù)據(jù)證明。然而,TEER的測試結(jié)果仍受設(shè)備、應(yīng)用頻率、溶液離子強(qiáng)度、溫度和皮膚表面積等因素的影響,且不同動(dòng)物模型的皮膚樣本也可能影響TEER結(jié)果,因此不同文獻(xiàn)報(bào)告的測量值并不一致,可用的數(shù)據(jù)仍然受限。本文選取了部分文獻(xiàn)中所報(bào)告的TEER測量值用于參考,詳見表6。

由于人體皮膚個(gè)體間和個(gè)體內(nèi)存在可變性和差異性,因此需根據(jù)實(shí)際需要確認(rèn)皮膚的供體數(shù)和重復(fù)數(shù)以驗(yàn)證對(duì)IVPT方法的標(biāo)準(zhǔn)化和可重復(fù)性,關(guān)于各監(jiān)管機(jī)構(gòu)對(duì)其詳細(xì)的說明可參考IVPT中皮膚設(shè)計(jì)需考慮的要點(diǎn)總結(jié)(見表 7)。

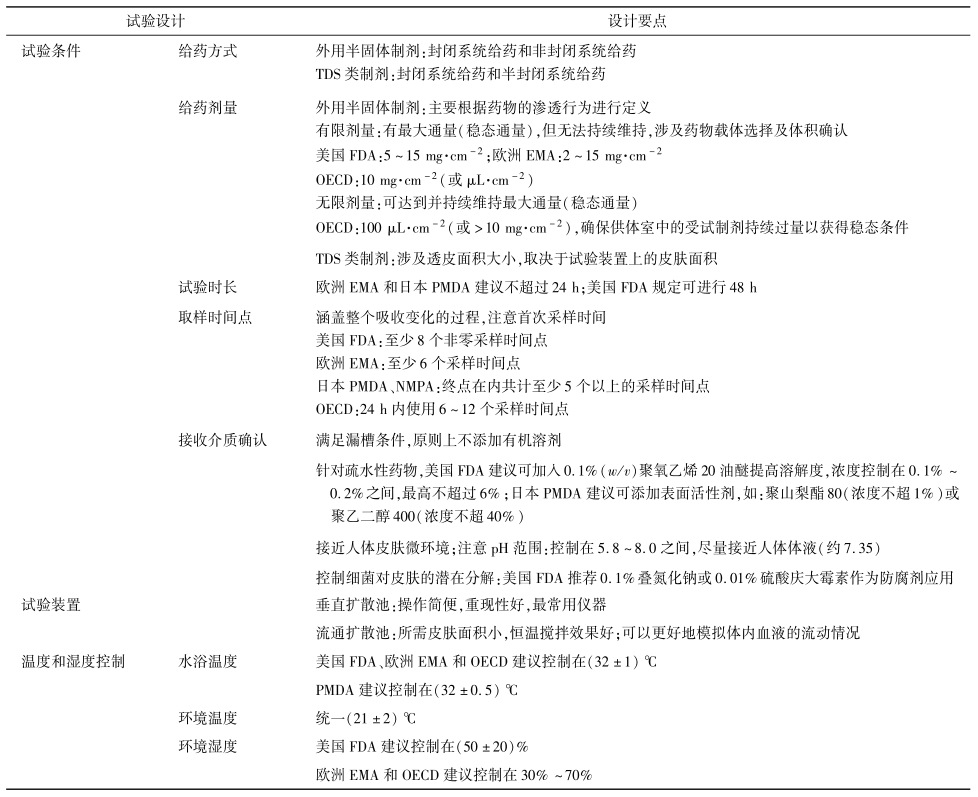
各監(jiān)管機(jī)構(gòu)對(duì)試驗(yàn)設(shè)計(jì)方面做出的具體要求不同,試驗(yàn)前需根據(jù)制劑種類和藥理作用,設(shè)計(jì)合理的實(shí)驗(yàn)方案。表8總結(jié)了IVPT中常見的試驗(yàn)設(shè)計(jì)要點(diǎn)。
3.1 試驗(yàn)條件
3.1.1 給藥方式
針對(duì)皮膚外用的半固體制劑,常見的IVPT有封閉系統(tǒng)試驗(yàn)和非封閉系統(tǒng)試驗(yàn)。由于封閉系統(tǒng)通常會(huì)導(dǎo)致皮膚逐漸水化,使角質(zhì)層的滲透性增加 ,因此在IVPT研究中大多進(jìn)行非封閉試驗(yàn)以模擬藥物經(jīng)皮滲透的真實(shí)情況。相反,當(dāng)被測物含揮發(fā)性成分時(shí),為確保試驗(yàn)的準(zhǔn)確性以及模擬真實(shí)的臨床情況,應(yīng)采用封閉系統(tǒng)給藥。Jung等使用乙醇作為載體研究兒茶酚的經(jīng)皮吸收,結(jié)果表明封閉條件下皮膚可滲透的應(yīng)用劑量為78%,而非封閉條件下只能滲透55%的應(yīng)用劑量。
針對(duì)TDS類制劑(透皮貼劑、貼膏劑),根據(jù)背襯材料的透氣性,IVPT給藥方式可分為封閉系統(tǒng)給藥和半封閉系統(tǒng)給藥。背襯材料特性的不同決定了氧氣和水蒸氣的透過性不同,從而影響了皮膚的水合程度,甚至可能影響藥物的釋放 。常見背襯層材料有聚酯?聚乙烯復(fù)合膜、聚酯?鋁?聚乙烯復(fù)合膜、聚酯無紡布、聚酯彈力布等。相較而言,一些膜材如聚酯膜以及聚酯?鋁?聚乙烯復(fù)合膜的阻隔性較好,作為封閉性背襯材料,制備的TDS類產(chǎn)品(特別是全身給藥的透皮貼劑)貼附在皮膚上,透濕性低,造成皮膚水合程度高,有利于藥物穿透皮膚;而具彈性的聚酯類無紡布、聚酯彈力布等對(duì)氧氣和水蒸氣的透過性相對(duì)于封閉性的背襯材料更強(qiáng),該類產(chǎn)品貼附在皮膚上,透濕性更高;同時(shí)不同于局部半固體制劑的完全開放狀態(tài),其又具有一定的封閉性,因此在IVPT中一般作為半封閉系統(tǒng)進(jìn)行試驗(yàn)。
3.1.2 給藥劑量
針對(duì)外用半固體制劑,離體皮膚的給藥劑量可分為無限劑量和有限劑量。無限劑量是指在達(dá)到并維持受試物質(zhì)(每單位皮膚面積)最大吸收率的情況下,涂抹在皮膚上受試制劑的量。因此應(yīng)用于皮膚時(shí),其溶液濃度不會(huì)隨時(shí)間發(fā)生顯著變化,在試驗(yàn)中可以達(dá)到并維持最大通量(穩(wěn)態(tài)通量)。然而,在非封閉條件下給予皮膚有限劑量后,被測物的量會(huì)隨著時(shí)間的推移而減少,可達(dá)到最大通量但無法持續(xù)維持。有限劑量的確定涉及藥物載體的選擇及體積的確認(rèn)。給藥劑量過多可能導(dǎo)致皮膚水化或破壞屏障完整性。當(dāng)給藥劑量較小時(shí),需關(guān)注載體的表面潤濕性、黏度和密度等因素,考慮制劑能否均勻地覆蓋在皮膚表面。無限劑量的確定則需認(rèn)真考慮用于計(jì)算通量和表觀滲透系數(shù)的穩(wěn)態(tài)條件。
而針對(duì)TDS類制劑,目前沒有指導(dǎo)原則明確規(guī)定其給藥劑量。在IVPT研究中,透皮貼劑的給藥劑量涉及透皮面積大小,被裁剪面積通常取決于試驗(yàn)裝置上的皮膚面積,需保證透皮貼劑能完整覆蓋在皮膚表面。
3.1.3 試驗(yàn)時(shí)長和取樣時(shí)間點(diǎn)
試驗(yàn)時(shí)長和取樣時(shí)間點(diǎn)一般與目標(biāo)化合物的性質(zhì)及制劑處方的特性相關(guān)。采樣時(shí)間點(diǎn)作為實(shí)驗(yàn)參數(shù),其數(shù)量應(yīng)能涵蓋整個(gè)吸收變化的過程以完整描述動(dòng)力學(xué)吸收曲線。具體的采樣頻率需根據(jù)測試物質(zhì)的預(yù)期皮膚滲透率來定義,被測物的滲透速度越快,采樣點(diǎn)之間的時(shí)間間隔就越短。首次采樣的時(shí)間通常由被測物分析方法的檢出限決定,采樣點(diǎn)數(shù)量可能受分析成本等因素影響。因此,部分實(shí)驗(yàn)室可能根據(jù)以往經(jīng)驗(yàn)判斷采樣頻率,從而導(dǎo)致不一致的皮膚滲透特性。例如:研究金屬體外滲透的第1個(gè)采樣點(diǎn)通常設(shè)置為2h;而采用高靈敏度分析方法進(jìn)行連續(xù)采樣時(shí),檢測出金屬的經(jīng)皮滲透發(fā)生得更早,首次采樣時(shí)間則需控制在試驗(yàn)開始后的2h內(nèi)。
3.1.4接收介質(zhì)確認(rèn)
理想的接收介質(zhì)應(yīng)在滿足漏槽條件的基礎(chǔ)上盡可能接近人體皮膚微環(huán)境。在確定合適的接收介質(zhì)時(shí),應(yīng)根據(jù)被測物質(zhì)與皮膚的兼容性以及在接收介質(zhì)中的穩(wěn)定性和溶解度確定接收介質(zhì)的組成和pH。目前國內(nèi)外常用的接收介質(zhì)有生理鹽水、林格氏液、等滲磷酸鹽緩沖液。對(duì)于非活性皮膚制劑,用于評(píng)估水溶性化合物的接受介質(zhì)通常為pH7.4的磷酸鹽緩沖液;而脂溶性化合物一般難溶于生理鹽水和磷酸鹽緩沖液,需要加入添加劑改善藥物溶解性。
通常有機(jī)溶劑會(huì)改變角質(zhì)層中細(xì)胞間脂質(zhì)的結(jié)構(gòu)進(jìn)而增加皮膚滲透性,因此原則上在IVPT接收介質(zhì)中不建議添加有機(jī)溶劑。為保證漏槽條件,針對(duì)疏水性藥物,美國FDA建議可在基于生理緩沖鹽的接收介質(zhì)中添加 0.1%聚氧乙烯20油醚提高溶解度;日本PMDA則建議可添加對(duì)皮膚影響較小的表面活性劑以提高藥物溶解度,并推薦使用聚山梨酯80(Tween80)或聚乙二醇400(PEG400),但需控制濃度范圍。研究發(fā)現(xiàn),1%Tween80溶液不會(huì)對(duì) 藥 物 的 透 皮 吸 收 產(chǎn) 生 明 顯 影 響,但 以PEG400作為接受液時(shí),其體積分?jǐn)?shù)宜控制在20%以下 。
對(duì)于具有代謝活性的皮膚制劑,可使用基于生理的接收介質(zhì),如RPMI組織培養(yǎng)基或林格氏液。林格氏液作為接收介質(zhì),在支持皮膚活力方面相當(dāng)于細(xì)胞培養(yǎng)基。RPMI培養(yǎng)基通常可使皮膚保持24h以上的新陳代謝活性并維持皮膚正常的生理滲透壓。Gaucher等通過試驗(yàn)表明,相較林格氏液,皮膚在RPMI中可保留更大活力。
確定接收介質(zhì)的pH值在試驗(yàn)中也至關(guān)重要。正常皮膚表面的pH有助于調(diào)節(jié)表皮屏障穩(wěn)態(tài),并維持皮膚微生物菌群平衡 。在IVPT研究中,接收介質(zhì)的pH值應(yīng)盡量接近人體體液(約7.35并具有足夠的緩沖能力中和皮膚代謝產(chǎn)生的乳酸以維持皮膚正常的代謝活動(dòng)。根據(jù)藥5.8~8.0內(nèi)。
為了減輕擴(kuò)散池中細(xì)菌對(duì)皮膚的潛在分解,可加入一些不與藥物發(fā)生相互作用且不影響藥物滲透性的防腐劑,如 PEG400、疊氮化鈉或慶大霉素等。美國FDA建議可加入約0.1% 疊氮化鈉或0.01%硫酸慶大霉素作為IVPT的防腐劑。在一些時(shí)長為24h的研究中,疊氮化鈉可用于長期滲透測定,但毒性較大,且對(duì)皮膚結(jié)構(gòu)有破壞性,相較而言, PEG400和硫酸慶大霉素毒性較小 。
3.2 試驗(yàn)裝置
IVPT的裝置有垂直擴(kuò)散池(推薦使用華溶TD-12AT PLUS 透皮擴(kuò)散系統(tǒng))和流通擴(kuò)散池(推薦使用華溶DS-7CP PLUS 流池法溶出系統(tǒng))。為了最大限度地減少對(duì)被測物質(zhì)的干擾,擴(kuò)散池通常由許多化學(xué)性質(zhì)穩(wěn)定的惰性材料制成,如玻璃、特氟龍等 。垂直擴(kuò)散池最早是基于Franz提出的設(shè)計(jì),后期由Keshary等在其基礎(chǔ)上進(jìn)行改進(jìn)。由于操作簡便、重現(xiàn)性好,已成為體外透皮擴(kuò)散研究中最常用的儀器,用于評(píng)估皮膚滲透性、檢查活性成分和制劑的關(guān)系以及反映外用制劑經(jīng)皮透過的真實(shí)情況。流通式擴(kuò)散池所需皮膚面積小、恒溫?cái)嚢栊Ч茫m用于較長時(shí)間的皮膚滲透研究。同時(shí)流通池具有連續(xù)流動(dòng)的接收液,可以更好地模擬體內(nèi)血液的流動(dòng)情況,因此,當(dāng)需要對(duì)親脂性化合物經(jīng)皮滲透進(jìn)行更多與生理相關(guān)的評(píng)估時(shí),應(yīng)優(yōu)先考慮流通式擴(kuò)散池 。
3.3 溫度和濕度控制
IVPT中,接受介質(zhì)作為離體皮膚的微環(huán)境,水浴溫度過高不僅導(dǎo)致皮膚通透性增加,還會(huì)增大藥物的溶解度。Kilo等發(fā)現(xiàn),親脂性化合物(苯甲醚)和親水性物質(zhì)(1,4-二惡烷、乙醇)的皮膚滲透行為均呈現(xiàn)溫度依賴性變化。當(dāng)皮膚暴露3h后,隨溫度升高,皮膚累積透過量最高可達(dá)原來的3倍。
在研究期間,還應(yīng)對(duì)實(shí)驗(yàn)室的濕度進(jìn)行監(jiān)控和報(bào)告。環(huán)境濕度過高可能導(dǎo)致皮膚樣品的角質(zhì)層水合作用增強(qiáng),進(jìn)而影響體外皮膚滲透性。為了驗(yàn)證IVPT中濕度水平對(duì)皮膚滲透性的影響,Ishida等通過比較尼古丁透皮貼劑在臨床濕度水平(約50%)和過高濕度水平(約95%)下的體外皮膚滲透性,發(fā)現(xiàn)藥物在95%濕度下的皮膚滲透值顯著高于50%濕度下的值。
IVPT影響因素眾多,樣本間變異性大,為了減少潛在的試驗(yàn)偏差來源,在 IVPT的初步研究和最終的正式研究中,需進(jìn)行方法驗(yàn)證。IVPT實(shí)施成功的標(biāo)志之一就在于其能否區(qū)分不同的制劑產(chǎn)品 ,因此便涉及區(qū)分力的驗(yàn)證。對(duì)IVPT區(qū)分力的評(píng)估包括靈敏度和選擇性的驗(yàn)證。通過對(duì)靈敏度的研究可確定上樣量和劑量維持時(shí)間等方法參數(shù),進(jìn)而檢測藥物皮膚藥動(dòng)學(xué)(PK)變化的能力以反映藥物遞送差異。IVPT的選擇性則是指 IVPT方法區(qū)分“對(duì)照制劑”和“與對(duì)照制劑在藥物遞送方面存在差異的外用制劑或配方”藥物在皮膚PK差異的能力。關(guān)于靈敏度的驗(yàn)證,美國FDA有3種方式:① 對(duì)于含有揮發(fā)性成分的外用制劑,可通過調(diào)整上樣量以改變藥物遞送行為支持方法的靈敏度。② 可通過調(diào)整劑量維持時(shí)間來有效評(píng)估藥物遞送的差異和與藥物皮膚PK相關(guān)的變化。③針對(duì)同一制劑,還可以調(diào)整產(chǎn)品規(guī)格,用高、中、低3種不同的規(guī)格評(píng)估方法靈敏度。但通常情況下,第3種驗(yàn)證方式可能不會(huì)按預(yù)期那樣持續(xù)產(chǎn)生藥物遞送增加或降低的結(jié)果,因此,美國FDA不建議用此方法去論證IVPT的靈敏度。歐洲EMA 推薦用受試制劑50%的規(guī)格和參比制劑評(píng)估方法的靈敏度。對(duì)于選擇性的驗(yàn)證,美國FDA和歐洲EMA均建議將對(duì)照制劑、自研外用制劑和“已知不同于對(duì)照制劑”的第3種外用制劑進(jìn)行評(píng)估,提供支持性證據(jù)說明IVPT方法對(duì)藥物遞送的差異具有選擇性。日本PMDA關(guān)于區(qū)分性的評(píng)估則沒有相關(guān)規(guī)定。
IVPT研究的皮膚PK終點(diǎn)是基于表征藥物滲透和通過皮膚進(jìn)入接收液的速率和程度的參數(shù)。藥物的滲透速率常采用單位面積滲透速率(Flux或J)進(jìn)行表征,而藥物的滲透程度采用單位面積藥物累積滲透量(A)進(jìn)行表征。目前,各組織機(jī)構(gòu)關(guān)于IVPT數(shù)據(jù)處理的等效判定不同:美國FDA和歐洲(Atotal)作為評(píng)價(jià)指標(biāo),NMPA和日本PMDA關(guān)于IVPT的等效判定依據(jù)則為試驗(yàn)制劑與參比制劑的平均穩(wěn)態(tài)滲透速率(Jss)之比,其進(jìn)行了詳細(xì)對(duì)比總結(jié)見表9。
IVPT研究的皮膚PK終點(diǎn)是基于表征藥物滲透和通過皮膚進(jìn)入接收液的速率和程度的參數(shù)。藥物的滲透速率常采用單位面積滲透速率(Flux 或J)進(jìn)行表征,而藥物的滲透程度采用單位面積藥物累積滲透量(A)進(jìn)行表征。目前,各組織機(jī)構(gòu)關(guān)于IVPT數(shù)據(jù)處理的等效判定不同:美國FDA 和歐洲EMA主要采用最大吸收速率(Jmax) 和累積釋放總量(Atotal)作為評(píng)價(jià)指標(biāo),NMPA 和日本PMDA 關(guān)于IVPT的等效判定依據(jù)則為試驗(yàn)制劑與參比制劑的平均穩(wěn)態(tài)滲透速率(Jss)之比,其進(jìn)行了詳細(xì)對(duì)比總結(jié)見表9。
j:藥物通量,表示藥物滲透速率,即單位面積藥物透過皮膚的速率(g.com-2 ·h -1 );Jmax:藥物最大滲透速率;Jss:平均穩(wěn)態(tài)滲透速率;A:單位面積藥物的累積滲透量(g.com-2 ),表示藥物的滲透程度;Atotal:整個(gè)研究期間單位面積藥物累積釋放總量;tmax:藥物滲透速率達(dá)到最大時(shí)所需時(shí)間;Tg為滯后時(shí)間;Stotal:皮膚組織中保留的藥物的總量;Rtotal:殘留在皮膚或試驗(yàn)設(shè)備上的藥物總量;《新注冊分類的皮膚外用仿制藥的技術(shù)評(píng)價(jià)要求(征求意見稿)》在附件2針對(duì)IVPT數(shù)據(jù)處理的參數(shù)報(bào)告要求和日本PMDA 的指導(dǎo)原則一致;《皮膚外用化學(xué)仿制藥研究技術(shù)指導(dǎo)原則(試行)》、《化學(xué)仿制藥透皮貼劑藥學(xué)研究技術(shù)指導(dǎo)原則(試行)》針對(duì)數(shù)據(jù)處理的參數(shù)報(bào)告要求,未進(jìn)行具體規(guī)定
6.1 支持局部外用制劑的藥學(xué)變更
IVPT作為評(píng)估局部外用制劑BE的替代方法,可通過評(píng)價(jià)定性(Q1)、定量(Q2)變化對(duì)經(jīng)皮滲透的影響,進(jìn)而支持該制劑風(fēng)險(xiǎn)等級(jí)的變更。鹽酸布替萘芬乳膏(Lotrimin Ultra?,1%)作為一種外用抗真菌劑,原配方中含0.3%(w/w)二乙醇胺(DEA)充當(dāng)pH調(diào)節(jié)劑。作為一種堿化成分,DEA已被FDA批準(zhǔn)為非活性成分,但此成分經(jīng)研究表明可能有致癌的風(fēng)險(xiǎn)。該產(chǎn)品配方經(jīng)變更后,以 0.43%(w/w)三乙醇胺(TEA)代替了DEA。同樣作為堿化成分,TEA具有與DEA相似的結(jié)構(gòu)和理化特性。為證明制劑變更前后的BE,Mitra等以人體皮膚進(jìn)行IVPT研究,用于評(píng)估該配方變化對(duì)鹽酸布替萘芬經(jīng)皮膚吸收的影響。對(duì)結(jié)果進(jìn)行統(tǒng)計(jì)分析表明,當(dāng)前配方和新配方中,鹽酸布替萘芬的體外皮膚沉積和滲透方面沒有顯著差異,進(jìn)而證明了配方變化對(duì)鹽酸布替萘芬乳膏的皮膚滲透沒有任何顯著影響。目前該研究結(jié)果已被美國FDA接受,并被授權(quán)上市了新的Lotrimin Ultra? 乳膏。
6.2 作為支持局部皮膚科藥物BE證明的敏感工具
皮膚外用產(chǎn)品仿制藥的開發(fā)通常依賴于比較臨床終點(diǎn)BE研究,為了減少試驗(yàn)成本,可選用體外試驗(yàn)?zāi)P吞娲鶥E檢驗(yàn)。目前IVPT已被廣泛用于表征應(yīng)用于皮膚化合物的BA,有望與BE的體內(nèi)評(píng)估相關(guān)聯(lián)并進(jìn)行預(yù)測 。阿昔洛韋乳膏(Zovirax?5%)作為一種外用抗病毒藥,在比較臨床終點(diǎn)研究的可行性方面一直暫未確定,因此在美國還沒有經(jīng)批準(zhǔn)的仿制藥,可作為模型藥物代表許多局部皮膚科藥物產(chǎn)品。Shin等 通過比較不同配方組成的阿昔洛韋乳膏(5%,w/w)與美國的參比制劑來評(píng)估 IVPT作為支持局部皮膚科藥物產(chǎn)品BE證明的靈敏工具的有效性。通過對(duì)試驗(yàn)結(jié)果進(jìn)行統(tǒng)計(jì)分析,表明IVPT作為一種靈敏且有鑒別力的測試方法,可檢測不同配方的阿昔洛韋乳膏在皮膚中BE的速率和程度的差異。
6.3 體內(nèi)外相關(guān)性(in vitro-in vivo correlation,IVIVC)的預(yù)測與評(píng)價(jià)
隨著高質(zhì)量仿制藥的逐漸開發(fā),美國FDA曾在文件中指出,體外研究證明IVIVC是確定BE最準(zhǔn)確、最靈敏和最可重復(fù)性的方法之一。作為常見的體外研究模型,當(dāng)IVPT和體內(nèi)研究設(shè)計(jì)協(xié)調(diào)一致時(shí),IVPT可預(yù)測體內(nèi)BA,其試驗(yàn)結(jié)果可與體內(nèi)觀察到的BA數(shù)據(jù)密切相關(guān)。通常IVIVC的開發(fā)需要體內(nèi)PK信息,以及同一經(jīng)皮給藥系統(tǒng)(transder-mal drug delivery system,TDDs)產(chǎn)品至少3個(gè)級(jí)別的遞送速率。目前市售的雌二醇TDDs有多種藥物遞送率 ,因此可被開發(fā)為透皮產(chǎn)品的IVIVC模型藥物產(chǎn)品。Yang等首次嘗試使用市售的雌二醇開發(fā)IVIVC模型發(fā)現(xiàn),人體皮膚的體外滲透百分比與雌二醇的體內(nèi)吸收百分比之間存在很強(qiáng)的相關(guān)性。雌二醇TDDs構(gòu)建的IVIVC模型可通過體外滲透預(yù)測體內(nèi)血清藥物濃度。該模型已通過了內(nèi)部和外部驗(yàn)證,符合美國FDA 對(duì)IVIVC的建立標(biāo)準(zhǔn)。而Shin等則通過IVPT和體內(nèi)人血清PK協(xié)調(diào)研究評(píng)估不同尼古丁TDDs中尼古丁BA的潛在IVIVC。結(jié)果也表明通過IVPT計(jì)算的預(yù)測血清中尼古丁濃度與在受試者中觀察到的體內(nèi)血清中尼古丁濃度之間存在較強(qiáng)的IVIVC。
6.4 評(píng)估熱效應(yīng)對(duì)經(jīng)皮給藥系統(tǒng)中藥物滲透速度和程度的影響
當(dāng)皮膚外部被施加熱量或持續(xù)暴露于高溫下時(shí),可通過增加皮膚和外周血管的通透性加快TDDs的藥物釋放速度來增強(qiáng)藥物釋放 ,進(jìn)而有可能導(dǎo)致皮膚內(nèi)透過的藥物過量。通常為使TDDs在使用期間能夠維持恒定的藥物釋放速率,TDDs產(chǎn)品常被設(shè)計(jì)為含有過量的藥物。在高溫的影響下其藥物釋放速率極有可能發(fā)生變化,使體循環(huán)中的藥物濃度顯著升高的可能性大大增加。芬太尼作為一種毒麻藥品,過量使用則會(huì)危及生命安全,因此美國FDA已發(fā)布了關(guān)于芬太尼TDDs經(jīng)加熱或暴露于高溫下會(huì)產(chǎn)生威脅生命的不良反應(yīng)警告 。
目前試驗(yàn)人員已經(jīng)進(jìn)行了大量研究闡明熱量對(duì)皮膚外用產(chǎn)品在體內(nèi)和體外性能的影響,IVPT便是評(píng)價(jià)TDDs熱效應(yīng)的常用模型之一。Zhang等便以芬太尼為模型藥物,通過3種不同的芬太尼TDDs產(chǎn)品,確定可影響TDDs熱效應(yīng)評(píng)價(jià)的IVPT實(shí)驗(yàn)條件并重點(diǎn)研究了高溫條件下IVPT對(duì)TDDs中藥物滲透的影響。結(jié)果表明,當(dāng)溫度從32 ℃升高到42℃時(shí),芬太尼TDDs的滲透通量增加了2倍,與使用芬太尼水溶液測定芬太尼的皮膚滲透活化能一致。該團(tuán)隊(duì)同時(shí)開發(fā)了一種使用外部加熱燈的熱應(yīng)用方法評(píng)估熱效應(yīng)對(duì)尼古丁TDDs皮膚滲透的影響,結(jié)果同樣表明在尼古丁TDDs的IVPT研究中,不同熱應(yīng)用方案的模型預(yù)測與相應(yīng)的實(shí)驗(yàn)數(shù)據(jù)基本保持一致 。
IVPT作為皮膚遞藥制劑中代替等效性臨床試驗(yàn)的有效方法,通過評(píng)估藥物經(jīng)人離體皮膚的體外吸收動(dòng)力學(xué)來支持與參照藥物相比的治療等效性,可用于篩選藥物制劑、評(píng)價(jià)制劑載體系統(tǒng)促進(jìn)皮膚滲透的性質(zhì)和作用機(jī)制以及通過預(yù)測藥物分子的皮膚轉(zhuǎn)運(yùn)評(píng)估皮膚接觸化學(xué)品的系統(tǒng)性風(fēng)險(xiǎn)。針對(duì)涉及試驗(yàn)關(guān)鍵技術(shù)參數(shù)的影響因素,本文結(jié)合不同監(jiān)管部門發(fā)布的IVPT指南及國內(nèi)外文獻(xiàn)進(jìn)行了歸納總結(jié),包括皮膚、試驗(yàn)設(shè)計(jì)、方法驗(yàn)證和數(shù)據(jù)處理,同時(shí)補(bǔ)充了IVPT作為評(píng)價(jià)手段的部分典型案例說明其具體應(yīng)用供相關(guān)人員進(jìn)行參考。
IVPT目前已應(yīng)用廣泛,隨著指導(dǎo)原則的頒布及國內(nèi)外相關(guān)文獻(xiàn)的發(fā)表,IVPT的試驗(yàn)技術(shù)日趨成熟,操作也在逐漸規(guī)范,但仍存在一些問題需要重點(diǎn)關(guān)注。首先,針對(duì)的應(yīng)該是皮膚來源。皮膚在試驗(yàn)中對(duì)結(jié)果可靠性的影響巨大,一方面針對(duì)不同供應(yīng)商,應(yīng)如何建立統(tǒng)一皮膚標(biāo)準(zhǔn);另一方面涉及皮膚銀行問題以及后續(xù)應(yīng)如何對(duì)皮膚進(jìn)行處理,還需要行業(yè)間進(jìn)行更多地交流以共同推進(jìn)行業(yè)標(biāo)準(zhǔn)的建立,完善規(guī)范IVPT。其次,應(yīng)如何對(duì)數(shù)據(jù)進(jìn)行合理地統(tǒng)計(jì)處理以及證明IVPT與體內(nèi)的相關(guān)性也是需要解決的難點(diǎn)。為了驗(yàn)證體外試驗(yàn)的IVIVC,研究人員進(jìn)行了大量體外實(shí)驗(yàn)去模擬真實(shí)的生理?xiàng)l件 。但目前為止,針對(duì)半固體外用制劑,沒有任何公開文件表明為已上市的產(chǎn)品建立IVIVC方法指南,大多研究者是參考美國FDA發(fā)布的關(guān)于口服緩釋制劑IVIVC標(biāo)準(zhǔn)。由于口服緩釋制劑在體外溶解的過程不可能模擬藥物通過人體表皮滲透的復(fù)雜機(jī)制,因此目前研究透皮給藥系統(tǒng)的IVIVC只能參考A級(jí)相關(guān)性。而體外條件與真實(shí)生理?xiàng)l件始終存有較大差異,怎樣證明不同模型的IVIVC以及建立合適的IVPT模型去準(zhǔn)確測定產(chǎn)品經(jīng)皮滲透性并反映藥物的有效性,還需繼續(xù)研究探索。
略
如需原文,請聯(lián)系小編(代老師15012941165)