時間:
一、流通池法概況
隨著制劑技術的飛速發展,大量新劑型的誕生以及目前對于溶出度測定方法體內外相關性(IVIVC)的要求,傳統的溶出度測定方法(籃法、槳法等)在進行制劑質量控制時遇到許多新的問題及難題,如微量藥物制劑的測定,微球、速釋等制劑的測定。流通池法作為一種新型的溶出度檢測方法,除用于傳統固體口服制劑的溶出度測定外,還可用于特殊劑型粉末、栓劑、顆粒劑、混懸劑、微球及藥物洗脫支架(drug eluting stens, DES)等的溶出度和釋放度測定,避免了已有溶出度測定方法因吸附平衡導致的溶出困難及機械攪拌的弊端,尤其適用于難溶性藥物的溶出研究,能更好的模擬體內生理環境,更具有區分力。
二、流通池發展歷程
流通池法,即流通池溶出度檢查方法,是不同于傳統溶出度測定的一種新的溶出測定方法,在美國藥典、歐洲藥典、日本藥典、中國藥典均有收載。流通池最早可以追溯到1957年,FDA專家開發了一種應用于延時釋放制劑的溶出設備,此設備由儲液罐、氣泵、樣品池組成。
20世紀70年代,SOTAX設計了第一臺商業化的流通池法溶出儀。1981年,FIP(國際藥學聯合會)提議將流通池法作為USP1&2法的一個替代方法,用于難溶或長效釋放的劑型的溶出,并且在1989年寫了Pro-Pharmacopeia說明。USP和EP在1991年收錄流通池法,JP在1996年收錄流通池法,Chp在2020年收錄了流通池法。
三、流通池法裝置構成
《中國藥典》2020年版0931項對第六法(流池法)做了詳細說明。
裝置由儲存溶出介質的貯液池、用于輸送溶出介質的泵、流通池和保持溶出介質溫度的恒溫水浴組成,接觸介質與樣品的部分均為不銹鋼或其他惰性材料制成。應使用正文項下規定尺寸的流通池。
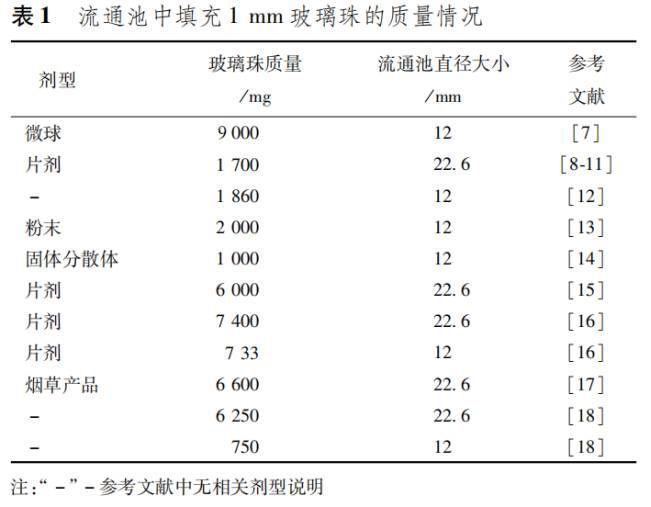
流通池,常用形狀尺寸如圖1和圖2所示,由透明惰性材料制成,垂直安裝在一個帶過濾系統裝置上(參見各品種項下的具體規定),以防止未溶解的顆粒從流通池頂部流出;標準流通池的內徑一般為12mm/6ml 和22.6mm/14ml,流通池的錐形部分通常充填直徑為1mm的玻璃珠(不同研究中填充玻璃珠的重量有所不同,具體情況見表1),在倒置的錐體下端放一直徑為5mm的玻璃珠以防止樣品池中的介質倒流入管路;樣品支架用于放置特殊制劑,如植入片。樣品池浸沒在恒溫水浴中,以保持溫度在37℃ ± 0.5℃。
流通池用一個夾子和兩個固定的O形環固定。泵應與溶出儀分開,以防止儀器受到泵產生的振動影響。泵的水平位置不得高于溶出介質的貯液池。連接管應盡量短,可采用內徑為1.6mm的聚四氟乙烯惰性材料制成的法蘭接頭。在泵的作用下溶出介質向上流過流通池,流速通常在240-960ml/h之間。標準流速為4ml/min、8ml/min和16ml/ min。泵應能提供恒流(變化范圍為規定流速的±5%),流速曲線應為正弦曲線,脈動頻率為120±10沖/分,也可使用無脈沖泵。采用流池法進行溶出度檢查的方法,應規定流速與脈沖頻率。
四、流池法分類
4.1 閉合式系統
閉合式系統,是一種循環式流通池法(如圖3),將樣品置于特別設計的流通池中的樣品架上,溶劑預先加熱至37℃,由恒流泵泵入。溶劑經過裝有恒溫裝置的水浴,進入流通池的下端,與樣品接觸,并由流通池的上端過濾后流出,其溶出曲線如圖4。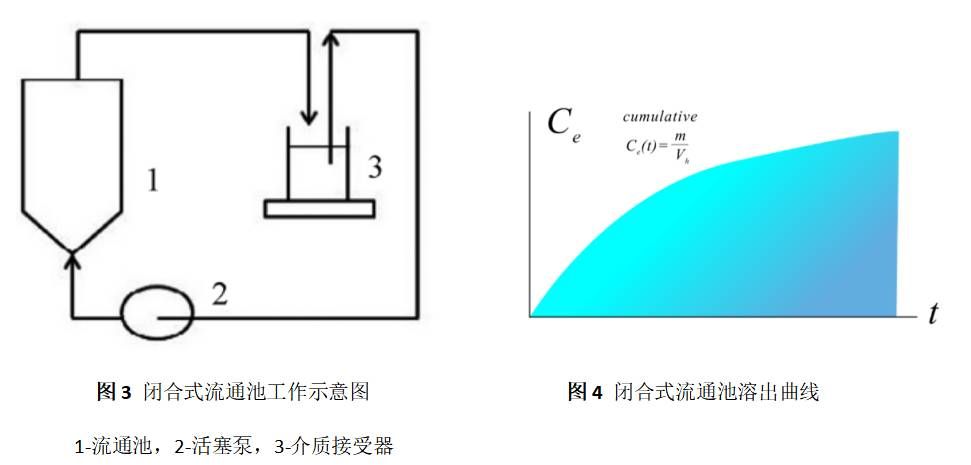
4.2 開放式系統
開放式系統,是一種開放式流通池法(如圖5),與閉合式系統的主要區別是溶出介質通過流通池后不再返回,可自動改變溶出介質種類或pH,用于模擬胃腸道pH變化。溶出介質在通過流通池后使用自動取樣裝置按時間點進行取樣,大量新鮮溶出介質不斷流經被測樣品,讓固體隨時與新鮮介質接觸,逐漸溶解到最后溶盡為止,溶出部分會及時被帶離流通池,始終保持漏槽條件要求,其溶出曲線如圖6。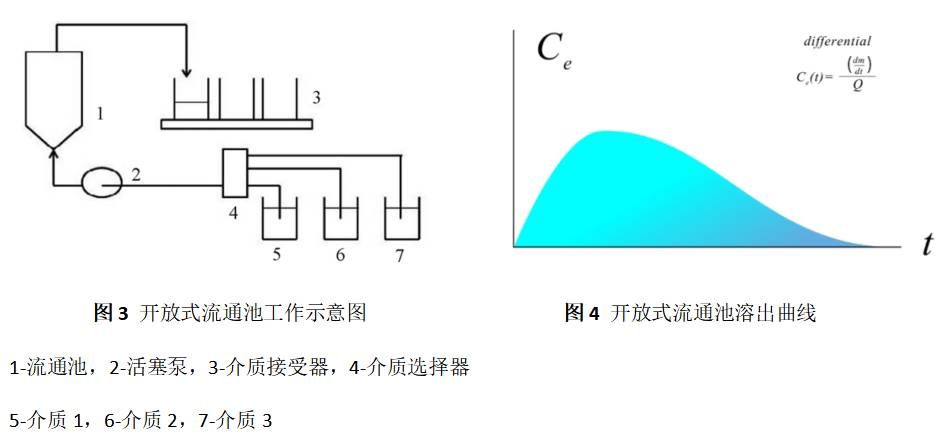
五、流通池法特點
5.1 流通池法優點
①更容易維持漏槽條件,開環模式更適用于難溶性藥物的溶出度測定;②實驗過程中可以隨時改變溶出介質組成、pH等條件;③流通池上端安裝有過濾裝置,可以避免不需要的過濾離心等步驟,根據不同制劑的粒徑要求可以采用不同類型或不同粒徑大小的過濾器;④流通池可與其他分析儀器連接實現在線分析,有研究表明,槳法與其他在線分析儀器連接時可能會發生探針堵塞等情況,而使用流通池法通過過濾裝置可以將未溶解的藥物顆粒留在流通池從而避免探針堵塞等問題,方法重現性良好。通常將流通池法與紫外分光光度法(UV)聯用進行體外釋放研究,而Rudd等將流通池與在線HNMP檢測聯用進行體外釋放行為研究,可區分復雜晶體納米混懸劑環境中單個成分的存在。Yoshida等使用粒子圖像測速系統(PIV)連續采集圖像獲得流體的瞬時速度矢量以評價具有和不具有蠕動泵的流通池中流體流動的特性;⑤具有良好的體內外相關性(IVIVC):IVIVC是一種預測性數學模型,描述了體外藥物釋放與體內血漿藥物濃度或藥物吸收速率之間的關系。其中,A級體內外相關性被認為是體外與體內數據相關關系的最有力證明,也是唯一被監管機構認可的、可用于替代生物等效性研究(BE)的相關性等級。已有研究證明,流通池法用于納曲酮或利培酮聚合物微球的溶出度測定具有體內外相關性;⑥設計不同類型的流通池,如粉末和顆粒流通池、親酯劑型制劑流通池、混懸劑流通池等,可以更好地滿足不同劑型質量控制的需要;⑦泵的類型可以改變,流速的控制依賴于泵,所以泵的類型也是影響方法穩定性的重要因素。Yoshida等研究兩個脈沖泵(半正弦,全正弦)和 1個非脈沖泵的流量變化對USP標準片劑溶出度的影響,發現由不同類型的泵提供的流體流量變化產生不同的溶出曲線。滿足USP要求的由泵脈沖引起的瞬時流體流量變化是影響流通池法系統中片劑溶出度的1個重要因素。不同的泵和過濾器類型見表2。
5.2 流通池法缺點
雖然流通池的優點有很多,但應用流池法模擬難溶性藥物體內溶出的研究還很少且仍缺乏對方法的系統研究。另外流池法還存在一定的缺點,例如:①研究儀器操作較為繁瑣,在使用過程中應周期性地監控關鍵的實驗參數,如溶出介質的體積與溫度、溶出介質的流速等;②存在儀器昂貴,成本較高等問題,應根據實驗具體情況綜合考慮方法的選擇。
六、流通池法的應用
6.1 流通池法在片劑及膠囊劑中的應用
口服固體藥物片劑和膠囊劑的溶出研究多采用槳法等傳統溶出方法,但在溶出時不易更換溶出介質且溶出介質體積選擇受限。Van der Vossen等采用流通池法及模擬新生兒和嬰幼兒禁食狀態的溶出介質對兒童用藥硝苯地平和氯羥去甲安定片劑及膠囊劑進行溶出試驗,為兒童用藥藥動學研究提供了體外試驗依據。目前,國外關于流通池法片劑和膠囊劑的體外實驗研究相對較多。李輝等采用槳法和流通池法兩種溶出方法考察了尼莫地平片實驗制劑和參比制劑體外溶出行為的一致性,得到了不同實驗結果,而流通池法更接近體內實際情況,具有更好的區分力,理論上能為BE研究提供更有力的數據支持。這為片劑溶出度研究和國內流通池法的應用提供了新的研究思路。
6.2 流通池法在納米混懸劑中的應用
納米混懸劑是1種純藥物亞微米膠體分散系統,通常具有較高的載藥量,良好的水分散性和物理穩定性等特點。納米混懸劑能夠有效解決藥物溶解性差和載藥量低等問題,因此得到廣泛應用。Forrest等評估了包括槳法(USP2法)、透析、反向透析囊法,以及流通池法在內的幾種不同的體外釋放方法在納米混懸制劑篩選和工藝開發中的應用。結果表明,流通池法優于USP2法及透析和反透析囊法。美國藥典USP2法和反向透析囊法由于不具有代表性的流體動力學特性,對納米混懸劑的黏度差異不敏感。由于水溶性差的化合物堵塞了膜孔,因此不適合使用透析囊法。流通池法能更好的模擬體內流體力學且更易維持漏槽條件,是唯一能夠根據組成、加工參數、粒度分布(PSD)和黏度區分納米懸浮劑的釋放方法。研究者們還研究了納米混懸劑以儲庫形式或層狀形式放置于流通池時對藥物釋放的影響,層狀放置時藥物溶出速度更快一些。也有研究在溶出介質流動前將混懸劑置于流通池的玻璃珠頂端或將藥物納米混懸劑放入透析袋中然后置于流通池中進行體外釋放實驗。納米混懸劑樣品的具體放入方式靈活多變而方法的重現性有待于進一步的研究和優化。
6.3 流通池法在微球制劑中的應用
微球是1種通過不同的給藥方式產生長效治療作用的控釋制劑,其可以在數周或數月內長時間釋放藥物以達到緩釋效果。流通池法可以有效地用于研究蛋白質負載的微球以及小分子負載的微球,且方法重現性良好。有研究比較了流通池法和樣品分離法用于負載蛋白質(牛血清白蛋白)的微球的體外測試,雖然蛋白質在玻璃珠疏水表面上的吸附會導致蛋白質總體累積釋放百分比的異常降低,但可以通過使用合適的表面活性劑(例如十二烷基硫酸鈉)來避免這種情況。Tipnis等使用流通池法進行布地奈德聚(乳酸-羥基乙酸)共聚物(PLGA)微球的體外釋放研究并優化了關鍵儀器參數和介質參數,方法的優化可以為其他微球制劑的體外釋放條件提供參考。藥物從聚合物微球的釋放與聚合物降解、藥物擴散、聚合物的性質,以及藥物聚合物相互作用有關。Kohno等采用流通池法研究了PLGA相對分子質量差異對利培酮微球釋放的影響。結果表明,聚合物的玻璃化轉變溫度及微球的孔隙率和粒徑比聚合物的相對分子質量的影響更大。通過優化實驗過程中的儀器參數和介質參數流通池法法有望在微球制劑中得到更廣泛的應用。
6.4 流通池法在口腔膜劑中的應用
Speer等對流通池法進行改進,將流通池與3D打印的膜劑支架結合(流通池法+FH3D法),使膜劑可以在不同的流速和不同的介質中進行釋放,從而模擬藥物在胃腸道的轉運。引入3D打印膜劑支架后,可以在實驗過程中使膜劑保持在恒定位置,從而減小誤差,在研究膜劑釋放時更具有區分力。另外,流通池法使用的介質體積較小,可以很好的模擬人口腔中唾液的體積,從而更好地模擬膜劑在口腔的釋放,樣品支架的使用將樣品室內的有效容積減少到大約3ml,這與生理唾液的體積更好地吻合。但仍需要進行體內研究以探究流通池法+FH3D法是否能夠預測口腔膜劑的體內性能。有研究表明,流通池法+FH3D法導致雙層膜劑(ODFDL)的藥物釋放速率降低,故該方法可用于檢查膜劑保護層的完整性,進行單向藥物釋放研究。以上流通池法與3D打印技術的聯用使方法更具有區分力,可以更好的模擬體內生理條件。
6.5 在栓劑中的應用
栓劑是指原料藥與適宜基質等制成供腔道給藥的固體制劑。Hori等使用轉籃法、槳法、透析袋法(DT)和流通池法等4種溶出方法研究了含有對乙酰氨基酚(AAP)的親脂性栓劑的釋放特性,發現使用流通池時最終AAP的最大溶出量(Q)約為100.4%~100.8%,平均溶出時間(MDT)約為70.9~90.3min,溶出效率(DE)約為74.7% ~80.3%,使用轉籃法時,AAP釋放效果不佳。透析袋法與流通池法結果相似,但膜滲透成為限速步驟,隱藏了釋放動力學,因此,不推薦使用該法。相比于槳法,流通池法對水動力學強度的依賴性較小,且數據可重復性和一致性好。韓煦等采用流通池法在不同流速和不同溶出介質下研究消糜栓劑中不同指標成分的溶出度,發現流通池法不同參數設定影響消糜栓劑中指標成分的溶出度測定。流通池法可作為栓劑溶出度測試的有效方法。
6.6 流通池法在DES中的應用
盡管第1個DES在2002年獲得了監管部門的批準,但關于其體內和體外的釋放行為研究有限。此外,體內研究通常集中于血液中的藥物水平而不是血管壁中的藥物濃度。血管壁是抗增殖劑的目標部位,只能在去除支架后的動物模型中確定藥物的組織濃度,而體外研究可幫助研究DES的體內釋放行為。目前,用于研究DES的體外釋放行為的方法主要有溶出介質體積較小的孵育法、往復桶法和流通池法。有研究者考慮到藥物在組織中的分布,引入水凝膠作為模擬植入支架的組織。將流通池法進行改進得到血管模擬流通池,從而研究氨苯喋呤從藥物支架中的釋放,發現單獨使用流通池法可能會高估藥物的釋放,血管模擬流通池法可作為更具有生物相關性的溶出度測定方法。使用血管模擬流通池法時,藥物的釋放情況與水凝膠基質的組成有關。這為流通池法的進一步改進以用于特殊劑型提供了參考。
七、展望
隨著大量新劑型的涌現,傳統的溶出方法存在一定的局限性,如攪拌不充分、溶出介質的體積選擇受限,以及不能很好地模擬體內環境等缺點。流通池法可以對傳統溶出方法進行彌補,樣品支架的設計解決了樣品漂浮問題,介質體積可以大于1000ml或小于400ml,可更好地模擬兒童胃腸道環境,適用于片劑、膠囊劑、微球、納米混懸劑、栓劑、膜劑及DES等的溶出度測定。流通池法還可以隨時改變溶出介質,但該方面的研究較少。目前,華溶已經成功開發出新一代的國產流通池,可自動改變溶出介質種類或pH,用于模擬胃腸道pH變化;并可根據不同劑型,選擇從2到32ml/min的不同流速。當然隨著制藥研發技術的不斷提升,國內關于優化儀器參數和關鍵的實驗參數的研究還需要不斷提高,走向國際化。
參考文獻:
《流通池法在藥物制劑中的應用進展》