時間:

翻譯:華溶-唐伊浠
審核:華溶-段云劍
摘要
使用垂直擴散池的體外釋放試驗(IVRT)是一種評估局部劑型性能和更好地了解產品理化特性的成熟方法。垂直擴散池(VDC)是測量半固態產品的藥物釋放最常用的設備,已使用50多年;然而,這種技術往往受制于高變異性和不充分的再現性。各種方法參數影響藥物釋放和釋放曲線的相關變化。本手稿的目的是檢查VDC設備的關鍵參數和使用其開發的方法,并強調開發、驗證和實施高效VDC方法時必須充分理解的。
一、簡介
體外釋放試驗(IVRT)作為支持外用產品開發的工具已存在約50年。早期研究是以了解當時可用的傳統類固醇乳膏和軟膏的釋放特性;Shah和其他人對氫化可的松和倍他米松二丙酸酯半固體產品進行了多次釋放速率測定。還包括引入垂直擴散池(VDC)和術語“Franz”擴散池的創造。
VDC是開發和驗證IVRT方法的最常用設備。還有其他可接受的系統,如浸沒池和USP4,但這些系統不在本文的范圍內。VDC通常由硼硅酸鹽玻璃制成,并由兩個隔室組成:供體室在實驗過程中保存藥物以及接收室是能夠容納合適體積的接收液并在實驗過程中從接收池中部分或全部取出樣品的部位。接收室設計為通過水夾層或干式加熱源保持恒溫。在供體室和接收室之間放置一個合適的惰性膜,該膜用作藥物的固定表面,并介于在兩個腔室之間的。目的在于保持藥物和介質完全分離。美國藥典第1724章更詳細地描述了VDC,并根據工業界、學術界和監管機構領導的意見,推薦了儀器的具體尺寸。描述了各種尺寸,其中理解孔口直徑、接收室體積和供體室大小是盡可能降低變異性的最關鍵因素。在過去20年中,各種出版社回顧了IVRT作為支持局部產品開發的工具的各個方面和應用,從非無菌半固體劑量表(SUPAC-SS)的放大和批準后變更到最近擬定的外用局部藥物分類系統(TCS)。
1997年,發布了第一份關于IVRT使用的監管文件,以支持SUPAC-SS。該機構的指導文件允許使用IVRT代替臨床試驗,對商業產品進行某些改變。幾個級別的變化,包括生產地點和規模的變更、生產工藝和設備的變更以及藥品組成的成分的某些變化(例如,輔料等級或供應商以及單個輔料的數量),允許使用IVRT作為工具,以證明生產前和生產后批次之間的等效性,而不是臨床試驗。
因此最初的法規發布后,整個制藥行業對開發IVRT方法的需求大幅增長,并開始成為局部用藥產品開發項目的必要條件。監管機構對QbD作為局部用藥產品開發的一部分期望也有所提高,這就產生了需要額外的工具來優化產品性能。因此,應用IVRT來了解釋放機制的變化及成分和工藝參數的變化,可以更好地了解高質量局部產品的開發。
無論開發新藥還是仿制藥,開發與產品并行的IVRT方法可優化不同開發階段的藥物配方和生產工藝。藥物中活性成分的釋放特性可深入了解產品的微觀結構,尤其是在長期穩定性研究期間,因此可在產品開發期間優化藥物的物理特性。IVRT方法還可通過在臨床評估過程中實施修改配方來建立一致性,從而為臨床開發階段之間的新藥物的同一性提供支持。這些應用程序中的每一個是降低整個開發計劃的風險所以都至關重要,并證明了在整個產品開發策略的早期實施這種性能測試是合理的。
在過去20年中,仿制藥的監管批準顯著增加;然而,局部外用仿制藥的監管批準一直滯后。對于局部用藥,在作用部位測量藥物濃度通常是不可行的,血漿濃度少是生物等效性(BE)的良好指標。因此,建立BE的必需是進行臨床終點研究,并且是批準在局部給藥發揮其作用的品牌和非品牌仿制藥品批準的實質性障礙。為了克服開發局部外用仿制藥的障礙,美國食品藥品監督管理局(FDA)實施了新策略。例如,當一個仿制藥符合定性(Q1)和定量(Q2)相似性標準時,IVRT以及一些理化或藥效動力學檢測可用于證明微觀結構(Q3)相似性,作為實施臨床試驗的替代方案。自2005年以來,已發布了幾份生物利用度(BA)和BE指導文件。雖然首次發布的關于阿昔洛韋軟膏的指南非常簡短和籠統,但關于阿昔洛韋軟膏、氨苯砜凝膠,和伊維菌素乳膏非常具體和詳細,概述了高效液相色譜法(HPLC)和IVRT方法的開發和驗證以及仿制藥與參比產品的關鍵研究比較的要求。
二、方法驗證
一旦為特定產品開發了合適的IVRT方法,應在產品開發期間的時間對其進行充分驗證。過去20年的各種法規突出強調了使用VDC驗證放行方法的方法。在上述FDA指導文件中,FDA最近從VDC開始詳細描述了方法驗證的監管期望。儀器應通過確認表面積、擴散池體積、溫度控制和攪拌速率進行適當鑒定。在進行整套研究時,也應監測和維持適當的實驗室環境控制。驗證應包括對以下方法屬性的適當評估:1)原料藥在接收介質中的溶解度和穩定性;2)與膜結合的原料藥;3)釋放率的批內和批間精密度;4)釋放速率的線性;5)恢復、質量平衡和劑量消耗;6)辨別敏感性;7)鑒別選擇性;8)鑒別特異性;9)使用改變藥物的補充鑒別選擇性;10)最關鍵方法參數(例如,劑量體積、接收介質組成和pH值、攪拌速率、溫度)相關的耐用性。上述各屬性的具體描述在FDA的阿昔洛韋乳膏指導文件中找到。HPLC方法的驗證建議與現行的美國食品藥品監督管理局(FDA)生物分析方法驗證指南或國際協調會議(ICH)分析方法驗證協調三方指南Q2(R1)一致。盡管IVRT樣品基質不像某些生物基質那樣復雜,但通常預期生物分析方法驗證原則,可能是因為IVRT被用于支持臨床研究的生物等效性。
三、VDC方法參數
VDC方法有幾個參數要達到最佳、可接受的性能必須嚴格控制。主要方法參數包括接收介質的溫度、擴散池尺寸(例如,孔口直徑、供體室尺寸和接受室體積)、采樣時間、膜、接收介質、攪拌速率。適用于產品應用于供體室以及使用方法。在開發VDC方法期間,應適當選擇每一個參數,并根據實驗數據證明其合理性。仔細選擇每個參數可導致開發的方法具有精密度、可重現性、對劑型中的各種變化具有區分性且適用于驗證。另一方面,參數選擇不當可能導致方法具有在實驗內和實驗間具有很高的變異性,從而難以從數據中得出充分結論。
前面提到的每個方法參數都將進行更詳細地檢查,然后討論各方法參數如何影響使用VDC的IVRT方法的整體變異性。
3.1溫度
膜表面接收介質的溫度應嚴格控制,并根據使用部位進行合理調整。32±1℃對于大多數用于皮膚表面的產品是合適的,37℃±1℃更合適用于直腸或陰道應用的產品,在將藥物應用至供體室之前和實驗結束時,應測量各擴散池中的溫度,以確認整個實驗期間溫度都在適當范圍內。
3.2擴散池(VDC)尺寸
不同尺寸的擴散池可從多家供應商處購得。美國藥典第1724章描述了常規的擴散池尺寸。如果使用VDC的其他尺寸,則應適當證明其合理性。在開發方法一種新方法之前,應仔細考慮擴散池的三個方面:供體室的尺寸、孔口直徑和接收室的體積。首先,供體室的尺寸(即容積)會影響在實驗期間維持滲透率不受劑量的影響的能力。如果活性成分迅速釋放到接收室中,并且在實驗期間使用的劑量被大部分釋放到接收室中,則可能需要更大的供體室,同時增加的使用劑量以保持無限劑量。第二,孔口直徑會影響藥物滲透到接受池的百分比。通過使用較小的孔口直徑可以將釋放百分比降至最低。相反,通過使用更大的孔徑可以增加釋放量。第三,接收室的體積可用于增加或減少液體接收介質的容量,以確保在最終采樣時間維持“漏槽”狀態。接收介質越大,“水槽”就越大。擴散池的最佳尺寸是特定于產品的,并應使用實驗數據進行適當論證。
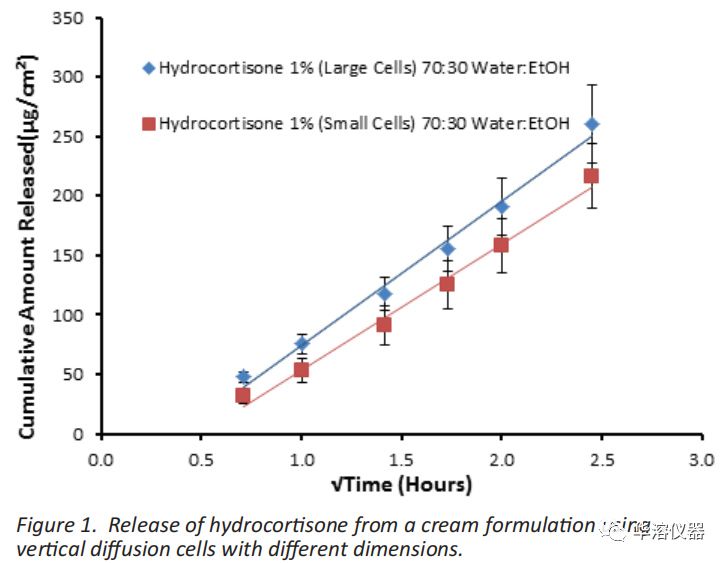
作為VDC設計對藥物釋放影響的示例,圖1顯示了使用70:30的水:乙醇作為接收介質和Tuffryn作為滲透膜從氫化可的松乳膏中釋放氫化可的松。使用兩組不同尺寸的擴散池。較大的接收池具有約1ml體積,表面積1.767cm,而較小的接受池具有約8ml體積,表面積1.0cm。對于大池和小池,應用于供體室的乳膏量分別是大池400毫克和小池1g。盡管釋放速率相似且相當,但大池的應用劑量釋放百分比為12%,而小池僅為2.5%;隨著施用量的增加和孔口的越小,釋放率的百分比越低。雖然在這種情況下,釋放速率沒有顯著變化,但不同的池體尺寸可能導致相同藥物和相同VDC方法的釋放速率大相徑庭。
3.3取樣時間和步驟
通常在4-6小時內進行取樣,每個擴散池至少取5個點。該持續時間在實驗上是可行的,當其他方法參數合適時,通常可以在該時間范圍內實現線性釋放區域的識別。采樣時間的選擇應與藥物的釋放量和時間的平方根呈線性。當抽取一定量的接收介質時,應立即同時更換等量預熱的介質體積,以便在整個實驗過程中膜的下表面與接收介質保持接觸。樣品應從適當混合的擴散池體中間位置抽取。
3.4合成膜
該合成膜在實驗過程中用作藥物的惰性保持表面。膜將覆蓋供體室與接收室之間的交叉處,孔口本身是將確定藥物的可用表面積,而不是膜。在IVRT實驗中,有多種市售合成膜可使用(例如PTFE(聚乙烯四氟乙烯)、PVDF(聚偏二氟乙烯)、聚碳酸酯、聚砜、聚醚砜、尼龍和纖維素)。這些膜有不同的孔徑和直徑都可以從供應商處購買。
合成膜不應成為藥物釋放的限速因素,不應與產品中原料藥結合或對分析測定產生任何干擾。合成膜應與藥物和所選接收液具有良好的相容性。
3.5接收液
在IVRT方法開發期間,接受液可能是最關鍵的參數選擇。接受液應具有較高溶解藥物的能力,以確保在整個實驗過程中保持漏槽條件(即活性成分的釋放速率不應受藥物在接收液中溶解度的限制,并且活性成分在接收池中的溶解度是在最終時間點所取樣品濃度的5至10倍)。不符合漏槽條件的方法不能應用于得出有關藥品性能的結論。所選溶劑還應與膜以及樣品分析的分析方法兼容。活性成分在接收液中應足夠穩定,以支持在適當溫度下進行實驗,在必要時支持再次進樣的分析時間或需要采集后儲存期間,都生成數據的穩定性。此外,接收液應提供線性和精確的釋放速率在單個實驗,足夠的釋放率從一個實驗到另一個實驗,從一個科學家到另一個科學家的釋放速率的充分重現性,以及在FDA阿昔洛韋乳膏指導文件中所述對有意改變的藥物之間的區分。
3.6攪拌速度
所有擴散池的攪拌速率應一致。許多市售擴散池系統的轉速為600轉/分,但如果能證明在整個實驗期間實現接收液能夠充分混合,則可證明其他速度也可以采用。
3.7上樣量
通常,將不少于300毫克的藥物上樣到供體室,其通常足以完全覆蓋膜的表面。實驗期間,藥物的釋放動力學應符合Higuchi假設的無限劑量要求,以確保方法的最佳性能。一般而言,在實驗期間,不超過30%的所用藥物應釋放至接收液中,以確保在供體室中保持無限劑量;因此,大于300毫克的劑量是合理的,以確保在整個實驗中保持無限劑量。如果藥物完全覆蓋膜的表面,并且在實驗的最終采樣點的供體室中保持無限劑量,則小于300毫克的量也是合理的。當供體室中藥物的量成為速率限制時,允許釋放超過應用劑量的30%可導致釋放曲線的非線性。釋放曲線的斜率將下降,導致出現釋放飽和。線性不足可能導致釋放率數據的變異性,并影響數據的總體質量;因此,建議采用30%釋放臨界值,以確保數據精確且重現性。
3.8應用方法
由于有多種可接受的VDC設計,因此將劑型輸送至供體室的方法可能有所不同。此外,劑型本身的物理性質(例如粘度)可能是如何將藥物最好遞送至供體室的一個因素。已經實施各種方法,包括使用金屬刮刀將劑型鋪到聚四氟乙烯晶片中間,使用不同體積的注射器,并將產品直接倒在膜的表面上。這方法應該最低限度地影響劑型的流變性,并且具有重現性,以使釋放速率不受應用方法的影響。
四、方法的常見變異性來源
與任何分析方法一樣,IVRT方法和計算釋放速率具有一定的可變性。IVRT方法的某些方面需要大量的人為人為干預(例如,樣品制備、將產品應用于供體室、采樣),這比其他成熟的分析方法具有更高程度的可變性。許多已發表文獻描述了相關的可變性,包括原始SUPAC指導文件,強調了從根本上了解這種可變性的來源以及如何更好地控制它的重要性。在IVRT實驗中經常觀察到變異性,有幾個輸出;理解IVRT數據的表達方式是理解和識別潛在誤差來源的關鍵。一般而言,通過IVRT方法可觀察到三種不同類型的變異性,稱為“池體內變異性”、“實驗內變異性”和“日常變異性”。
釋放率曲線是根據單位面積活性成分累積釋放量與時間平方根的函數(即釋放速率的線性關系)線性回歸生成的數據(圖1);因此,釋放速率是基于擴散池內給定時間段至少5個點計算的。單個擴散池體內樣品濃度的變異性可能導致較差的線性關系,這可描述為“池體內變異性”,因為它發生在單個擴散池內。釋放速率的線性關系應在單個池體內> 0.90,以盡量減少多個池體之間的變異性。
典型實驗方案包括給定藥物進行6次重復,以計算平均釋放速率。在這6份重復樣品中,變異系數理想地應為≤ 15%(釋放實驗,華溶客戶一般期望為5%),以便得出有意義的結論;盡管變異性可能高達20%,但根據作者的經驗,仍認為足夠精確。這種類型的變異性可描述為“實驗內變異性”,因為它是根據單個實驗中多個擴散池的釋放速率計算的。
單個產品的釋放速率實驗可以是由多名科學家在多天內進行。較差的耐用性方法可以表示兩次實驗之間的時間變化;這種變異性可描述為“日常變異性”。在穩定性項目中,對于單一產品在多天內進行的釋放率實驗示例是來自初始數據點(T=0)的釋放率數據可與在指定儲存條件下延長一段時間后生成的后續數據點(例如,T=3個月)進行比較。在不同時間由不同科學家進行實驗時,VDC方法必須具有重現性。
為了始終最小化可變性并生成精確且具有重現性的數據,必須考慮實驗方案中的影響因素,并確定通過改進技術和實施實驗室控制的最小化因素。在一個給定實驗中,有許多潛在的變異性來源,包括劑型本身、適當選擇兼容的VDC設計、樣品制備、樣品應用方法、取樣技術和接受液的組成。這些因素中的每一個都將被更詳細地討論。
藥物劑型和物理性質某些劑量劑型的物理性質可能比其他劑型更容易發生變異性。物理性質可能影響藥物從劑型基質中的釋放速率,并有助于與開發的IVRT方法相關的變異性。劑量的類型和劑型的復雜性將導致在釋放率曲線中觀察到的變異性程度(制劑可能導致的釋放實驗的高變異性)。具有多相的劑型(例如,面霜和乳液)比單相劑量劑型(例如,凝膠)更復雜;劑量形式的復雜性使得變異性難以控制。活性成分在從劑量中完全釋放之前可能需要在制劑內通過多個階段完全釋放進入接收室和接收液。此外,多相劑量形式通常對剪切應力更敏感,其物理穩定性可能在樣品制備期間或樣品應用至供體室間受到影響。
同樣,含有溶液中藥物百分比和混懸液中藥物百分比的劑型是更復雜的劑型的另一個示例,具有增加固有變異性的趨勢。活性成分可能需要在劑型在完全釋放到接收液之前或在接收液的界面處。
例如,內部研究表明,極性藥物(如阿昔洛韋)在軟膏混懸液中存在時,其釋放曲線通常具有很高變異性,而乳膏制劑的變異性可能更易于控制。類似地,對于存在多種劑量形式(洗劑、乳膏和軟膏)的藥物(如地奈德),釋放曲線的內在變異性因每種劑型的復雜程度而異。
4.1VDC供體室
美國藥典第1724章描述了兩種不同的供體室設計。第一個模型使用聚四氟乙烯晶片制造供體室,將產品放置在合成膜頂部。晶圓片通常是高度為1.5毫米,直徑為15毫米,市面上也有其他尺寸。在晶圓片頂部組裝支撐盤,使用夾具將供體室固定至接收室之前將產品封閉。在該模型中,晶圓片定義了產品接觸膜的表面積,在將晶圓片和圓盤完全固定到接收室之前,將產品應用于到供體室。
第二個模型使用磨砂玻璃供體室組合磨砂玻璃接收室來創建兩個腔室之間的界面。兩個腔室中的孔具有匹配的直徑,通常為11.28或15毫米,因此限定了產品接觸膜和接收液的表面積。在該模型中,將供體腔完全固定至接收腔后,將產品應用至供體腔。該模型中的供給室通常為18毫米高度,約為標準晶圓的10倍。
在這兩種類型的供體室之間存在三個重要的差異需要注意。因為聚四氟乙烯晶圓模型在膜下方沒有相應的表面來為藥物提供支持,所以晶圓模型可能不適合低粘度或流動的制劑。使用具有低粘度制劑的該模型可能導致制劑滲漏至晶圓孔形成的規定表面積外,在藥物產品暴露于接收液中產生變異性,可能導致“池體內變異性”。如果暴露的表面積從一個擴散池到下一個擴散池是是不同的,釋放速率的變異性也可能在實驗中增加。磨砂玻璃模型適用于低粘度制劑,甚至與液體制劑兼容,因為磨砂玻璃接頭提供了足夠的界面以防止泄漏。
其次,使用聚四氟乙烯晶片時,供體室的容量因高度降低而受到限制。當使用標準尺寸晶片時,供體室的容量約為200-400毫克藥物,而無晶片的供體室的容量是5-10倍。
需要注意的最后一個不同點是供體室完全固定至接收室上的點。使用磨砂玻璃模型時,在將產品應用到擴散池之前,將腔室固定在一起,減少了對膜表面的接觸,并使將藥物輕輕輸送到膜表面更具挑戰性。由于減少了使用的方法,因此該模型應用程序方法例子受到了限制。對于某些藥物,樣品使用方法可改變產品的物理特性,并導致池體內和實驗內變異性。
4.2樣品制備及上樣方法
如果操作不當,樣品制備技術和應用方法可能導致很大的變化。樣品制備是指用于從包裝(即管、泵、瓶)中收集藥物的方法,應用方法是指藥物如何應用于供體室。從劑型中收集足夠藥物的方法應簡單、一致,并對藥品施加最小剪切應力。剪切應力可在復雜的劑量形式(如洗劑和霜劑)中產生物理不穩定性;藥物內產生的變化可導致池體內變異性和實驗內變異性,因為藥物在給藥后在供體室中發生變化。在某些情況下,在給藥前對藥物進行細微的操作或混合可能是必要的,但應適當證明合理。

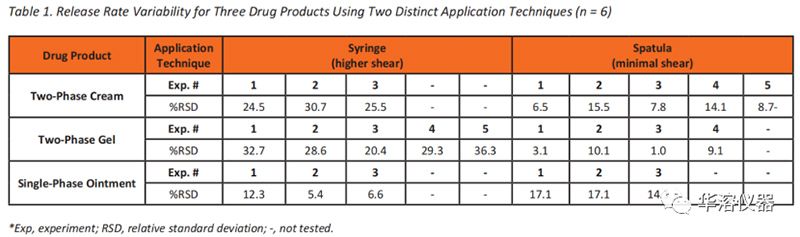
同樣,應用技術應簡單、一致,并對藥品施加最小剪切應力。有兩種典型的方法:用抹刀鋪開和用注射器注射。使用的方法通常取決于兩個因素:擴散池供體室類型和劑型的物理性質。如前所述,某些VDC需要使用聚四氟乙烯晶圓片,而其他VDC則不需要。使用聚四氟乙烯晶圓的模型需要更接近膜的表面,這使得配方可以用金屬刮刀輕輕涂抹鋪展,降低了復雜藥物的變異性,如果使用注射器輸送至供體室,則對施加至藥物上的剪切應力敏感。因此,當使用抹刀攤鋪的技術將藥物應用于供體室時,復雜藥物的釋放速率通常會降低變異性。例如,表1展示了使用單相和多相配方的兩種不同應用技術的釋放率變異性比較。釋放速率的精密度取決于兩相產品的應用技術。在上藥過程中最大限度地減少剪切力,可提高釋放速率的精密度和重現性。剪切對變異性的影響取決于劑型,因為更復雜的藥物會受到影響,而單相產品沒有。此外,圖2展示了使用每種應用技術的1%乳膏制劑中氫化可的松的釋放率數據。當該產品是使用抹刀涂抹產品時,與使用注射器涂抹產品相比,釋放速率的變異性較小。
制劑應平穩、均勻地涂敷在膜上,涂抹后不得與膜明顯分離。分離過程將在膜和藥物之間的界面處形成氣泡。接觸間隙的影響可對數據產生與接收液中的氣泡類似的影響。變異性可表示為池體內或實驗內變異性。一些產品(如疏水性軟膏)與使用注射器輸送相比,在擴散期間形成氣泡的趨勢增加。藥物與膜的物理相容性將對藥品間隙的形成有顯著影響。
4.3取樣補液方式
取樣技術是方法的關鍵組成部分,如果執行不當,可能會導致數據變異性。正確的取樣方法因擴散池的制造商而異;一般在美國藥典第1724章有描述。樣品應始終從膜表面下方的擴散池中心取出。應注意確保樣品不靠近擴散池的臂部,因為與擴散池中心相比,臂底部的混合是最小的。取樣過于靠近擴散池的臂可能導致樣品濃度較低和活性成分釋放速率明顯非線性。如果取樣程序不是使用校準的移液管進行的,則應對該程序進行適當驗證,以證明其不會導致池體內或實驗內變異性。
取樣后或取樣過程中,重要的是用等量的預加熱的接收液替換取樣的體積,以在實驗期間保持恒定體積。在取樣和更換過程中,避免將任何氣泡引入接收室至關重要。氣泡會上升至接收液與惰性膜之間的界面,從而減少藥物釋放的可用表面積。這種減少的表面積可導致釋放速率的降低,并導致池體內變異性。
4.4接受液的組分
在任何IVRT方法中,接收液的組成可能是最關鍵的參數。接收液的組成應與藥物和惰性膜相容,活性成分應在可用的體積內充分溶解并且應有良好的區分靈敏度。在方法開發和驗證期間,應在耐用性實驗期間評估釋放速率對接收液組成的靈敏性。應評估組分比例、pH值、離子強度和任何其他相關變化。使用改變的組合物的活性成分的釋放速率應直接與使用原始方法條件的活性成分的釋放速率進行比較。耐用性不足的方法(即,當改變的條件不符合SUPAC指南中所述的統計檢驗的“相同”標準時)在實驗間會導致出現重現性較差。
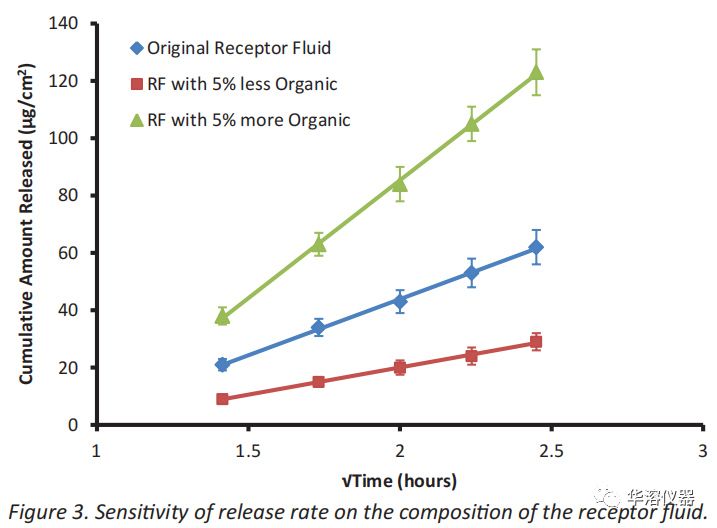
不同時間、實驗室或科學家之間的變異性(即日常變異性)。圖3顯示了一個實例,其中活性成分的釋放速率對接收液中存在的有機溶劑的量高度敏感。適度調整有機溶劑的量(~ 5%)導致活性成分的釋放速率存在顯著差異。在此情況下,向接收液中添加少量額外有機溶劑可使釋放速率翻倍。像這樣的靈敏度將使比較不同的科學家使用不同的接收液制劑在不同的日子產生的釋放率變得困難。高度控制的技術和對接收液制備的嚴格限制可以最大限度地減少高敏感接收液的影響(即,使用容積玻璃器皿和在使用當天制備接收液)。
4.5接受液的脫氣
一個非常常見的變異性來源是接收液脫氣和接收室中氣泡引起的。接收液脫氣是在很普遍含有水和有機成分混合物的接收液中。在IVRT實驗期間,含有表面活性劑的接收液會形成氣泡,僅在必要時使用,以實現活性成分的充分溶解。這些氣泡可在聚集膜和接收液之間的界面,從而減小可用于藥物釋放的表面積。表面積減少可導致釋放速率降低,并導致數據變異性。如果在實驗期間觀察到氣泡,則可通過小心倒置池體以通過開放取樣臂去除氣泡。根據何時氣泡被發現,變異性可表示為非線性的“池體內”,或表示為離開池體的“實驗內”。防止實驗過程中形成的氣泡可以在使用前接收液進行脫氣。
五、結論
在IVRT數據中觀察到的總體變異性有幾個因素。當前用于進行IVRT研究的設備需要大量的人力參與,特別是在樣品應用和取樣期間,使數據容易受到實驗誤差的影響。實施嚴格的實驗室控制和實驗方案,以及使用適當合格和驗證的VDC系統,可以減少較高變異性的可能性。隨著IVRT方法繼續發展為監管預期,標準化設備和增強的自動化將繼續觀察變異性,并改善實驗結果。
六、參考文獻
略