時間:

翻譯:華溶-覃海娜
審核:華溶-段云劍
摘要
格列齊特(GLZ)是第二代降血糖藥物,用于治療糖尿病型糖尿病。GLZ的低溶解度被認為藥物溶出和吸收的速率限制步驟,因此基于具有區分力的溶出試驗可預測其體內行為應導致相關的體外-體內相關性(IVIVC)。本研究的目的是通過IVIVC分析評價,使用美國藥典(USP)裝置3開發GLZ緩釋(MR)片劑的溶出度方法。評價了各種溶出度參數,以建立GLZ片劑的體外溶出測定方法。最終溶出條件(稱為方法3)在10h的總時間內使用了400um篩網和30dip/min的頻率,包括在鹽酸介質(pH 1.2)中的1h、在醋酸鹽緩沖溶液(pH 4.5)中的2h、在磷酸鹽緩沖溶液(pH 5.8)中的1h、在磷酸鹽緩沖溶液(pH 6.8)中5h和磷酸鹽緩沖溶液(pH 7.2)中1h。計算的點對點IVIVC(R2為0.9970)顯著大于其他方法。方法3的穩健性表明其可用于藥物等效性研究和GLZ的質量控制分析。
一、簡介
格列齊特 (GLZ) 是一種第二代低血糖藥物,廣泛用于治療非胰島素依賴型糖尿病。1) 它通過刺激胰腺原代細胞分泌胰島素發揮作用,并增加這些細胞對葡萄糖的敏感性。GLZ的一些化學性質如表1所示。該藥物是一種弱酸性化合物,具有高度親脂性,根據生物醫學分類系統(BCS)分類為II類藥物,溶解度低,滲透性高。GLZ的pH依賴性溶解度被認為是其在胃腸道中緩慢吸收的相關因素。為改善其可用性,將藥物緩釋片與親水性基質配制,以獲得活性藥物成分在24h內的更一致和更少pH依賴性釋放特征。制劑可在餐前、餐中或餐后給藥。
溶出度是評價劑型質量、指導藥物開發的重要工具,也可用于生物等效研究。在溶出方法開發期間,應評估體外參數,如表面活性劑的存在、pH、離子強度和培養基體積。溶出度測定儀器的選擇對于建立溶出度測定方法也起著關鍵作用。美國藥典裝置3(往復筒)專門設計用于緩釋片的溶出度評估,因為它可以模擬緩釋片在GIT中發生的理化和機械變化。17-19此外,與美國藥典第1號和第2號儀器相比,該儀器顯示出更優越的流體動力學控制,并在儀器參數方面提供了許多選項,例如溶媒、pH和攪拌速率。
為了描述劑量形式的體外特征與體內反應之間的關系,使用預測數學模型定義體外-體內相關性(IVIVC)水平。A級IVIVC是可達到的最高相關水平,代表體外溶出度和體內吸收之間的點對點關系。這種相關性被認為比其他相關水平更具信息性,從監管角度來看是有用的。由于其與特定緩釋片劑量形式暴露于體內的條件具有更大的相似性,因此使用USP3號裝置似乎更合適,并且已被證明對開發生物相關溶出度方法具有前景。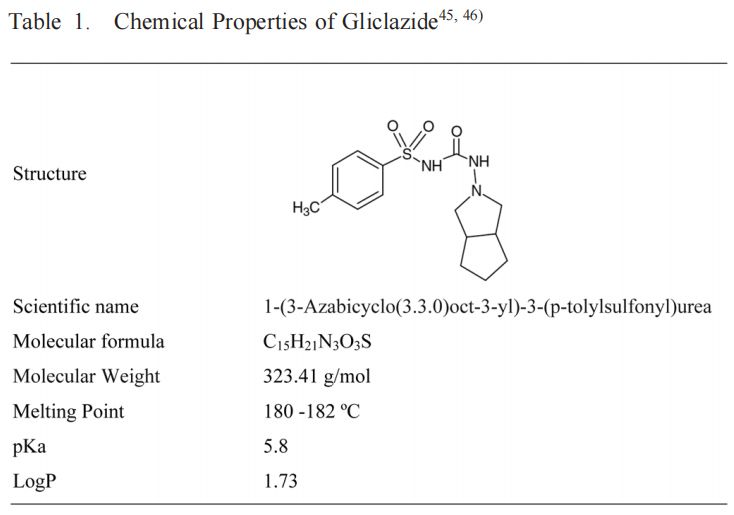
考慮到GLZ的低溶解度可能是其溶解和吸收的限速步驟,對GLZ的溶解和吸收進行了預測。基于使用生物相關介質的溶出度試驗的體內行為應導致更相關的IVIVC。文獻描述了使用美國藥典裝置2的GLZ-MR片劑的IVIVC,并建議美國藥典裝置3可能應用于GLZ-MR片劑。在此,我們使用USP裝置3評價不同溶出度參數,以開發GLZ MR片劑的方法,并基于IVIVC報告了一種溶出度方法,該方法與GLZ模擬和質量控制的進一步研究中的潛在用途高度相關。據我們所知,這是第一份使用USP裝置3描述GLZ MR片劑點對點IVIVC的報告。
二、實驗
2.1、化學品和試劑
GLZ參比標準品(純度98%)購自Sigma-Aldrich(圣保羅,巴西)。從Tedia(巴西里約熱內盧)獲得鹽酸、氯化鈉、氫氧化鈉、磷酸二氫鉀和乙酸銨。含30 mg GLZ的GLZ-MR片劑在當地藥店購買,由Diamicron?MR(菌落編號:3002512、巴西施維雅、巴西里約熱內盧)和Azukon?MR(細菌編號BM202063,Torrent制藥公司,里約熱內盧,巴西)。Diamicron?MR的輔料為磷酸氫鈣、羥丙甲纖維素、硬脂酸鎂、麥芽糊精和二氧化硅,而Azukon?MR由磷酸氫鈣、羥丙甲纖維素、聚維酮、硬脂酸鎂、一水乳糖和二氧化硅組成。所有過濾程序均使用0.45個聚偏二氯乙烯過濾器過濾器(米利克斯米利博爾,圣保羅,巴西)。水通過Milli - Q水凈化系統(Millipore,Bedford按照USP所述制備緩沖液。
2.2、樣品測定方法
通過添加過量的GLZ粉末(約在37°C下使用低速磁力攪拌(50rpm)將50mg)添加至含10mL不同介質的燒杯中24小時。燒杯頂部覆蓋有密封膜,以防止污染和蒸發。樣品經過過濾、稀釋,用紫外-可見分光光度計(Vankel, 50, Varian Inc., Palo Alto, CA, usa)在230 nm處測定濃度。30)評估介質為:鹽酸(pH 1.2);醋酸鹽緩沖液(ABS;pH 4.5);pHs值為5.8、6.8、7.2和7.4的磷酸鹽緩沖液(PBS值)。使用濃度2.5、5.0、10.0、12.5和15.0(μ g/mL)制備各條件下的五級校準曲線。全部測量一式三份。
2.2.1使用USP裝置1和2(籃式和槳式)進行溶出度研究
使用旋轉籃式(USP裝置1;USP1)和旋轉槳葉(美國藥典裝置2;USP2)在Hanson Research SR6溶出度測定儀(Hanson Research Corp.,美國加利福尼亞州查茨沃斯).溶出條件包括900 mL培養基(鹽酸pH 1.2;PBS=6.8和7.4),轉速為100轉/分,溫度為37±0.5°C,持續10小時。在第1、2、4、6、8和10h使用10μ m導管過濾器抽取5mL等分試樣,根據藥典通過紫外分光光度法進行體積稀釋和GLZ分析。制備濃度為0.6、2.5、7.5、12.5、15.0 mL的五水平曲線,所有測量均一式三份。制備各條件下的五級校準曲線,全部測量一式三份。
2.2.2、使用USP裝置3(往復式圓筒)對30mg GLZ MR片劑進行溶出度研究
(Diamicron?MR,參比產品;使用往復式圓筒裝置(美國藥典第3部分(USP3);生物制品瓦里安公司,CA,美國)在37±0.5℃的250ml介質中進行。比較了頂部和底部篩網的兩種篩目尺寸(841μm和400μm)。還評價了20、30和40次浸漬/分鐘(dpm)的不同攪拌條件。溶液和pH步驟在pH 1.2-7.2的生理范圍內變化。該系列緩沖液包括HCl(pH 1.2)該系列緩沖液由HCl (pH 1.2)、ABS (pH 4.5)和PBS (pH 5.8、6.8或7.2)組成。使用5s的排水時間和保持浸漬時間對儀器進行編程。在不更換介質的情況下,每小時手動收集5 mL等分試樣。取樣時,將圓筒置于溶出介質上方30 s。采集后,過濾樣品(0.45 M膜),體積稀釋,測定上述溶解藥物的百分比。根據校準曲線計算GLZ的累積百分比。在6份重復樣品中進行實驗,并將最終條件應用于GLZ的類似制劑。從先前報告的藥代動力學研究中獲得了空腹條件下GLZ的體外-體內相關性生物利用度數據。使用瓦格納- Nelson16,25,31的數值反卷積法估計藥物吸收(公式1). 采用這種具有一級吸收和消除的分布模型,因為它是最適合單室drugs25)的模型,并且已證明能夠充分描述藥代動力學格列齊特的特征。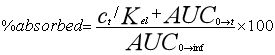
其中Ct為規定時間(t)的血漿濃度,Ke為消除速率常數。AUC0 →t是從0到時間t的曲線下面積,AUC0 →inf是從0到無窮大的曲線下面積。GLZ MR片劑的血漿濃度(ng/mL)和吸收分數(%)見圖1(A)。根據溶出度結果獲得體外溶出藥物的百分比。基于使用微軟Office Excel? 2010(微軟公司,美國華盛頓州雷德蒙德)進行的線性系統分析的IVIVC。使用體外溶出速率與藥物體內吸收之間的點對點關系(1至10 h)比較體內和體外數據。根據已公布的美國食品藥品監督管理局(FDA)指南,對點對點IVIVC(A級)進行了研究。
統計分析計算裝置1、2和3中溶解的GLZ的累積量,同時考慮培養基的不替換。使用線性回歸分析的平均值計算相關系數(R)(微軟公司,美國華盛頓州雷蒙德)。使用單因素ANOVA(GraphPad棱鏡5.0軟件,GraphPad,美國加利福尼亞州拉荷拉)比較了GLZ的溶出曲線。)根據p值評價相似性和差異,其中p > 0.05表示相似性,p<0.05表示統計學差異。使用差異(f1)和相似性(f2)因子進一步評價數據,監管機構廣泛采用這些因子來指示溶出曲線之間的相似性。溶出曲線之間的數值超出f1=0至5和f2=50至100的規定范圍之外的值表示溶解剖面之間的差異。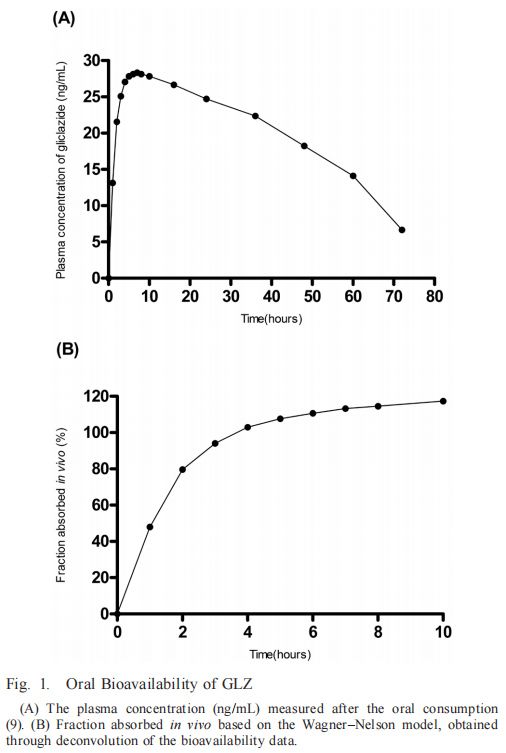
三、結果和討論
溶解度GLZ根據BCS分類為II類藥物,其低溶解度被視為藥物溶出和吸收的限制步驟。為了定義GLZ在溶出方法開發期間選擇用于代表GIT的培養基范圍內的溶解度,通過在高于飽和定量的條件下在攪拌下引入粉末狀GLZ測定不同緩沖液的最大容量24 h。在所有評價條件下均達到平衡。結果(圖2)證實了藥物在酸性介質中的低溶解度及其一般pH依賴性溶解度曲線,如先前報告中所預期。在最酸性條件(pH 1.2)下,溶解度略高于pH 4.5-5.8,然后隨著堿度升高至中性pH而增加。先前將pH 3.0-4.2的范圍報告為GLZ,的主要溶解度限制范圍,溶解度從該范圍逐漸增加。在給藥時,該藥物的溶解度被描述為吸收的限制因素,最高可達pH 6.9.7)在酸性介質中的較低溶解度通常被認為是GLZ速釋型劑量設計中的一個問題,因為整個劑量應在GIT的上部快速釋放。然而,GLZ的MR片劑采用親水基質配制,以獲得更一致和更少pH依賴性釋放。
四、使用USP裝置1和2進行的溶出度研究
到目前為止描述了GLZ的單一官方溶出度方法用于英國藥典中的IR片劑。該方法建議在100轉/分和900 mL PBS(pH 7.4)下使用USP2。這些參數最初適用于檢測GLZ片劑的MR制劑。USP1和USP2的比較(圖3A),在10小時內測定GLZ MR片劑的溶出曲線。與達到約95%最終水平的USP1相比,使用USP2時一致觀察到更高百分比的溶解藥物。USP1的溶出曲線平臺約為77%(f1= 20.93)。籃法與槳法之間的差異可能與基質片劑與籃式裝置的相互作用有關。先前關于使用USP1評價含親水性基質的藥物配方(如本文研究的GLZMR片劑)的報告表明,劑量基質形式的水化和溶脹可堵塞保留籃,可能破壞溶出的流體動力學,從而降低溶解藥物的總百分比。
由于GLZ在USP2中的溶出度較高以及藥物釋放速率與培養基組成的相關性,在USP2中測定了三種不同培養基的溶出曲線,維持了其他變量(圖3b)。培養基組成反映了那些最常用于鑒別溶出方法的組成,并且代表了胃和小腸狀況的生物相關模擬,其中GLZ的大部分吸收發生在胃和小腸條件下。在初始采樣時間點1 h,所有三種培養基的溶出水平均相等,2 h內無顯著差異。值得一提的是,在鹽酸中觀察到溶出藥物百分比出現統計學顯著性較大增加,在HCl (pH 1.2;與pH 6.8 (f1=48.29;f2 = 37.40)和PBS pH值7.4 (f1 = 39.41; f2 = 39.85)。在兩種ph值下,溶解的GLZ在PBS中的分布在整個時間過程中表現出相似的模式,最終達到的百分比略低于HCl。Priya和Murthy5)在其GLZ-MR片劑研究中觀察到相同的行為,并報告GLZ-MR片劑在供試緩沖液中的溶解度結果與釋放速率之間無特定相關性。因此,這表明輔料可能對GLZ-MR片劑的溶解度和溶出速率產生影響,尤其是在酸性介質中。此外,該觀察結果與Harrower8的報告一致)這表明GLZ-MR片劑的溶出度由制劑控制。該信息是我們研究中溶出度pH步驟組成的重要指南。
根據攪拌速率和藥物制劑,USP裝置2可能存在一些缺點,例如本研究中觀察到的錐狀現象。這種現象的特征是在溶出容器底部形成錐形,由研究藥物的可見顆粒組成,由系統的弱攪拌能力引起。這些顆粒不會適當溶解,可降低劑量形式溶出的總百分比。因此,有必要評估GLZ -MR片的其他溶出裝置,例如專門設計用于MR劑量形式的裝置3。盡管USP1和USP2未顯示出反映體內條件的理想流體動力學條件,但其用于評價不同溶出介質中的使用對我們的研究很重要。它提供了對GLZ-MR劑量形式溶出曲線的理解,指導了我們對溶出介質組成、pH步驟和使用USP3儀器使用的每種介質的時間周期的定義。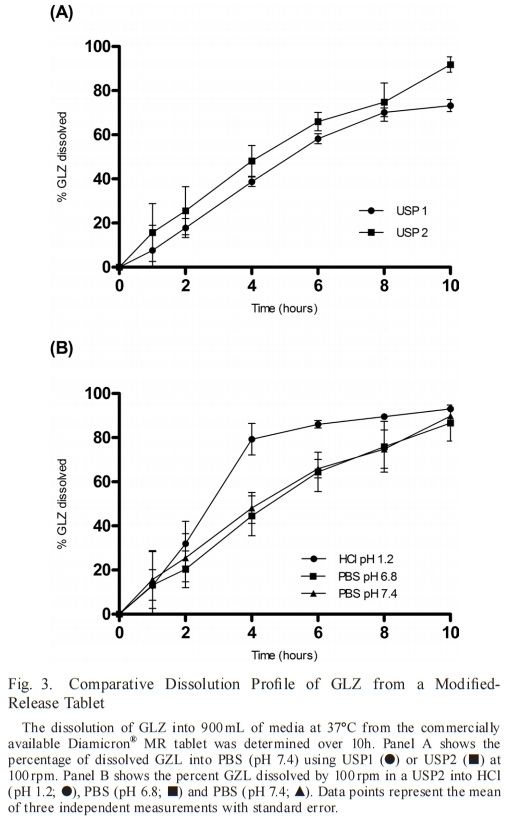
五、使用美國藥典儀器3的溶出度研究
5.1、溶出介質選擇
本研究中使用的溶出介質選擇基于物理pH范圍和胃腸道轉運時間。目標是使用pH值為1.2、4.5、5.8、6.8和7.2的緩沖溶液來呈現不同梯度的溶解介質。在方法開發期間,還對各溶出介質中的時間周期進行了變更。因此,本研究評價了溶出介質與不同pH步驟的6種不同時間組合(方法1-6;表2)。考慮到MR片中親水性基質的干擾,初始試驗采用兩種網孔尺寸(841和400um)評價頂部和底部篩網的孔徑的影響。在規定時間內,在一系列介質中進行該比較;鹽酸(pH 1.2;1h)、ABS=4.5(2h)、PBS=5.8(1h)、PBS=6.8(5h)和PBS=7.2(1h)。應用該條件M1是因為其包含來自生理范圍的大部分pH值,并且還基于文獻中描述的其他溶出介質組成。如圖4A,網孔尺寸的差異提供了顯著不同的溶出曲線(f1 > 15和f 2< 50)。USP3的操作涉及外管內內管的攪拌(以dpm為單位)。使用400um網孔獲得較高的溶解藥物總百分比,因為片劑的分解碎片保留在往復式圓筒的內管中,因此允許其在試驗期間在后續行的外管中溶解。相反,片劑的崩解碎片通過841um網片并在第一排的外管底部累積。因此,在使用841um網孔進行溶出期間,藥物未完全溶解,導致溶出藥物的總百分比降低。我們得出的結論是,400um型網格可以更準確地反映溶解情況,并在溶出方法開發的其余部分中采用。
5.2考察不同往復頻率合
接下來,考察不同往復頻率合(20、30和40 dpm),如圖4B。在鹽酸(pH 1.2)中進行1 h溶出度評價,隨后在PBS( 6.8)中進行9 h溶出度評價。根據FDA和USP關于多階段溶出系統的建議應用該條件,其中溶出通常采用1或2 h耐酸步驟,然后采用堿性步驟加磷酸鹽緩沖溶液進行基本步驟,長達12 h。此外,這種情況常見于MR制劑中經常被引用。隨著往復速率的增加,觀察到溶解藥物增加。20 dpm的浸沒率在溶出結束時呈現出較低的藥物溶出百分比,其平臺未達到80%的藥物溶出,表示溶出不完全。此外,認為20 dpm時的溶出度與30 dpm有統計學差異(f1= 20.82;f2=43.21;p > 0.001)和40 dpm(f 1= 28.90;f2=33.52;p > 0.001)。30和40 dpm無顯著性差異 (f1 = 10.21;F=54.98;p > 0.05)。30和40 dpm均顯示藥物總溶解百分比大于90%。盡管兩小時后40dpm的絕對水平高,但選擇30dpm的浸沒率用于使用不同介質/pH評價GLZ-MR片劑在USP3中的溶出度,以提供更溫和的攪動,這可能更具區分性。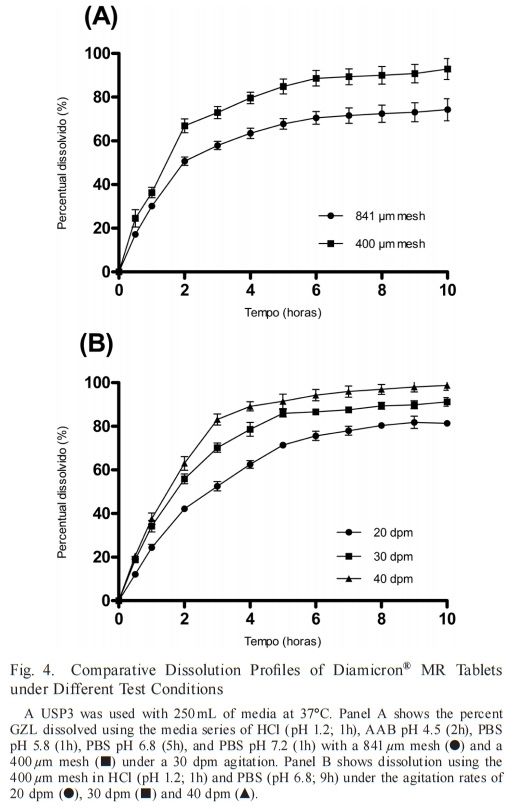
確定篩網尺寸和攪拌速率后,評價了溶出介質與不同pH步驟的六種不同時間組合(方法1-6;表2);(圖5). 如前所述,選擇這些介質來代表生理pH范圍和胃腸道傳輸時間。溶出方法(包括在HCl(pH 1.2)中的1小時或2小時)分別約35%和58%的GLZ溶出。一般而言,觀察到在HCl(pH 1.2)和AAB(pH 4.5)介質中的時間決定了GLZ的最終溶解百分比。這些方法之間的一致性差異是酸性步驟的持續時間。M1、M2、M3和M6在統計學上相似(f1≤5;f2 > 50;p < 0.05)。M4和M5的藥物溶出百分比均較低,其溶出平臺也未達到85%。此外,這兩種方法與M1和M3相比具有統計學差異(分別為p < 0.001和p < 0.01),因此未選擇用于進一步研究。還值得注意的是,在M1和M2中酸性步驟中使用2小時導致在溶解第3小時結束時幾乎80%的藥物溶解。總體而言,基于最終溶出度百分比和溶出曲線形狀相似性,M1、M2、M3和M6似乎適合評價GLZ-MR片劑。然而,使用USP3進一步細化理想溶出條件需要與生物利用度數據相關。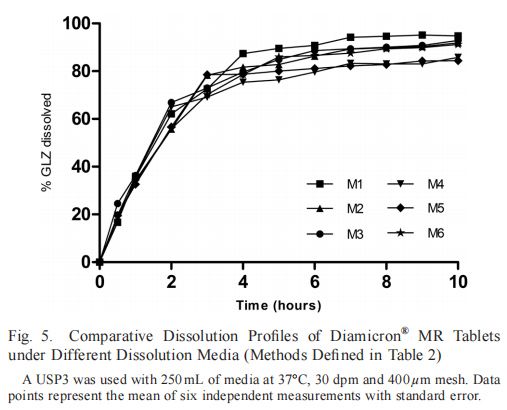
六、體內外相關性
進一步評價了不同溶出度裝置及其設置、培養基組成和孵育時間所獲得的數據,以建立GLZ MR片劑的IVIVC。使用USP1(籃)和USP2(槳)如圖1B中所示的吸收百分比與GLZ在不同介質中的溶解百分比進行比較。使用常規溶出度測定儀,兩者的吸收分數的R2 < 0.95(表3)。使用USP1和USP2在100 rpm HCl(USP1)中觀察到的最高R2=0.8906。與之前的USP2研究一致。根據美國食品藥品監督管理局的規定,本研究中使用USP1和USP2獲得的所有相關系數均遠低于推薦水平。在溶出試驗期間觀察到的籃子堵塞(USP1)和槳葉錐形效應(USP2),使用單一溶出介質最有可能不是適用于模擬GIT時MR制劑的體外溶出度。不同溶出介質和pH步驟的使用通常更具區分性,并且能夠更好地模擬體內條件。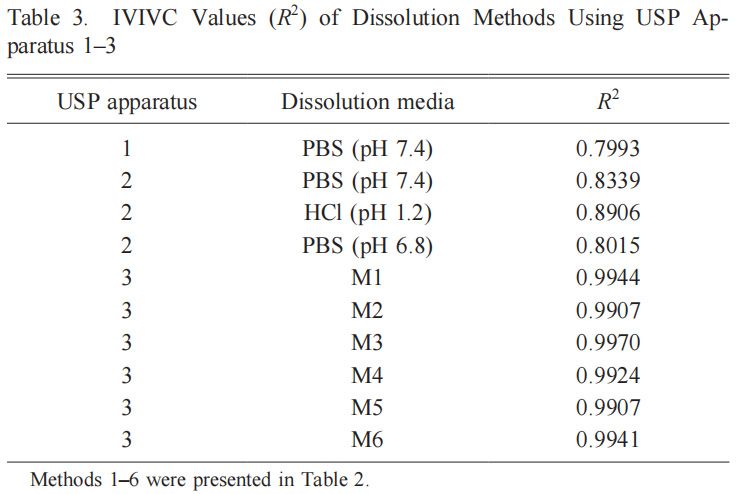
我們的重點轉向采用USP3和浸沒速率對IVIVC的影響,如圖6 a,表明三種速率中每種速率的關系數均較高(R > 0.95)。2如前所述,選擇30 dpm的浸沒速率進行進一步研究,以產生物理攪動的最低水平和溫和的溶出條件。根據不同溶出度方法1-6的圖(表3),每種方法還顯示GLZ MR 片具有高度相關性。最終,方法3呈現最高的相關系數(R = 0.9970;圖26 b)在本研究中進行的所有溶出度試驗中,因此,選擇其作為我們確定GLZ MR片劑IVIVC的最佳溶出度條件。
MR格列齊特片劑具有約100%的生物利用度、線性藥代動力學和單室模型,見圖1A. 在口服給藥后的前6小時內觀察到血漿濃度升高,隨后在第6至12小時達到平臺期。我們的體外溶出度研究也證實了這一規律。明確觀察到體內吸收分數和體外溶解分數曲線重疊,并通過建立點對點IVIVC(A級)反映,表明溶出試驗條件能夠模擬體內性能。結果還證明了USP3模擬能夠模擬MR劑型GIT條件的能力,以及該裝置用于開發GLZ-MR劑量形式的體外溶出試驗的適用性。
最后,使用USP3(方法3,30 dpm,400um)將具有最高IVIVC的溶出度方法應用于Azukon?MR30 mg(一種類似制劑),以驗證該方法在GLZ-MR劑量形式的質量控制和藥物等效性分析中的應用潛力。參比與相似MR片劑的溶出曲線之間的相似性見圖7. 在10 h結束時(f1=6.26和f2=65.74),從Azukon?MR片劑中溶出的GLZ百分比達到95.45% ±2.95,證實了其藥物等效性,并證實了使用USP3儀器用于MR-GLZ劑量形式的溶出方法的適用性。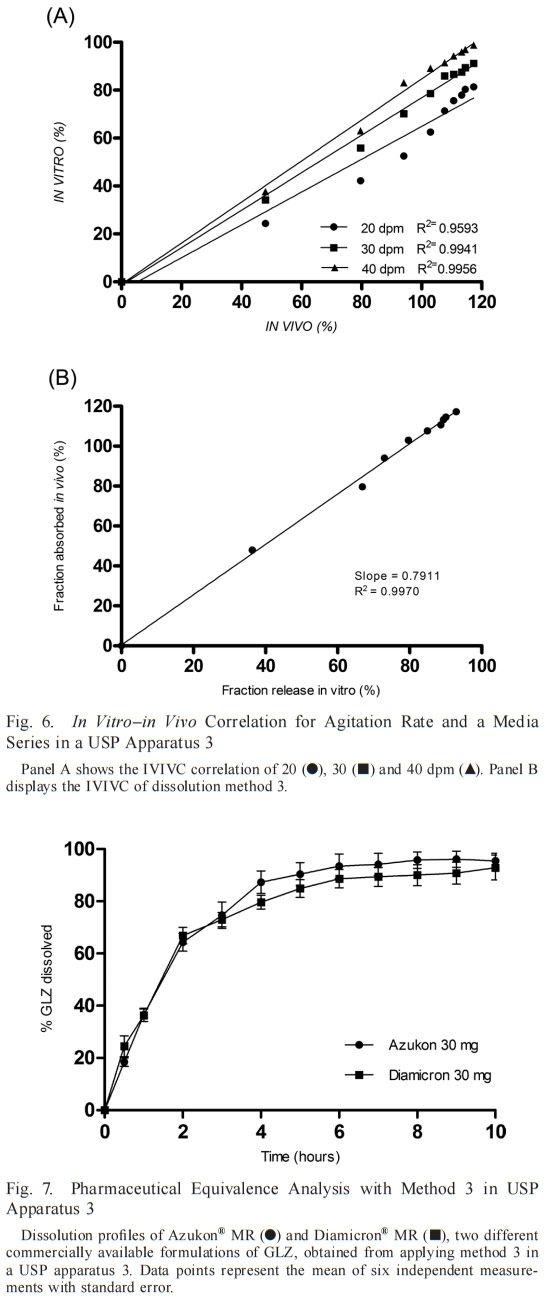
七、結論
USP3是建立GLZ-MR劑型IVIVC最合適的儀器。在使用該儀器執行的所有方法中,我們觀察到高水平的溶解藥物(Q > 85%)獲得高的相關系數(R2 > 0.95)。最終溶出條件為在30dpm的攪拌速率下,在一系列由HCl(pH 1.2;1h),ABS(pH 4.5;2h),PBS值(pH 5.8;1h),PBS(6.8 pH;5 h)和PBS(pH 7.2;提供了與pH步驟在GIT中的體外等同性。該方法顯示了最高相關系數(R2=0.9970),并提供了點對點IVIVC(A級)。開發穩健的溶出度方法用于MR劑量形式的GLZ在藥物等效性研究和質量控制方面具有潛在的應用價值。
八、參考文獻
略