時間:
 翻譯:華溶應用中心
翻譯:華溶應用中心
審核:工業藥劑發燒友
一、介紹
自20世紀60年代以來,制藥公司一直負責監控口服劑型在受控介質中溶出特性。早期溶出度檢測集中于制劑制造的質量控制。溶出度測試提供了獨特的監測綜合生產參數的能力,影響溶出速度的有:片劑硬度,賦形劑控制,粒徑等。該技術成為全球口服劑型常規檢測所必需的。早期溶出度測試的歷史記錄在文獻中。
早期溶出測試的另外的優點是活性藥物成分(API)及其相關劑型的相對簡單。這些可溶性藥物易于生物利用,因為它們在胃腸道中往往是高溶解性的和高滲透性的。因此,對于高溶解性和高滲透性的藥物,溶出度評估足以通過簡單的標準溶液(如水和酸性介質)來確保臨床表現。分歧主要側重于活性成分行為可預測的固體口服劑型的崩解和分散。在這些條件下,溶出度測試在預測人類臨床試驗中的表現是有效的,并被表示為臨床相關的方法。隨著藥物制劑技術的進一步發展,溶出測試在今天仍在使用的四種基本儀器上進行協調,通常由美國藥典(USP)的1法,2法,3法和4法。其他USP儀器指定,例如7法,傾向于用于非口服劑型。
今天,溶出度測試擴大了其應用范圍,并將其從簡單的質量控制測試向前推廣到用于預測體內/體外相關性(IVIVC)的可溶性和可滲透劑型以及許多其他臨床相關性。在溶出測試的開發年代中發現的簡單制劑,已經讓位于更復雜的技術,以提高溶解性較低的分子的生物利用度。本書的目標是超越以前提及的現有溶出度文本,主要表示可溶性藥物的溶出度測試,并且著重于目前分子在當前開發中的溶出度測試的問題。本文建立在以前的作品的堅實基礎上,這些作品目前應用于溶出和藥物釋放技術,重點是難溶性藥物。
二、改變藥物重點
USP1-4的溶出平臺是促進可溶性藥物上市的關鍵技術。所使用的技術、儀器和簡單的緩沖體系,理想地表征正在開發的劑型。然而,由于活性藥物成分(API)變得越來越復雜(就胃腸道的溶解度和滲透性而言), 這些簡單的藥物釋放機制并不與之相關。生物藥劑學分類系統(BCS)由Amidon等開發,作為美國食品藥品監督管理局(FDA)的指南,用于預測口服劑型腸道藥物吸收。BCS系統已經成為基于藥物溶解度和腸道滲透特性,對口服藥物吸收進行分類和評估的金標準。
2.1 BCS分類系統
BCS 對藥物的分類是基于這樣的前提,即當藥物溶解時,這個濃度可以穿過膜并與腸吸收相關。通過在人體胃腸道的代表性的各種條件和pH的體外化學測試建立胃腸道溶解性。藥物的滲透性是基于最初的親脂性測試,并在動物模型、組織研究、培養的上皮細胞如 Caco-2測試,并最終在人體(質量平衡,絕對生物利用度腸灌注測試等)中進一步研究。 隨著藥物溶解度和滲透性的建立,BCS系統將藥物分為四類,如表1.1所示。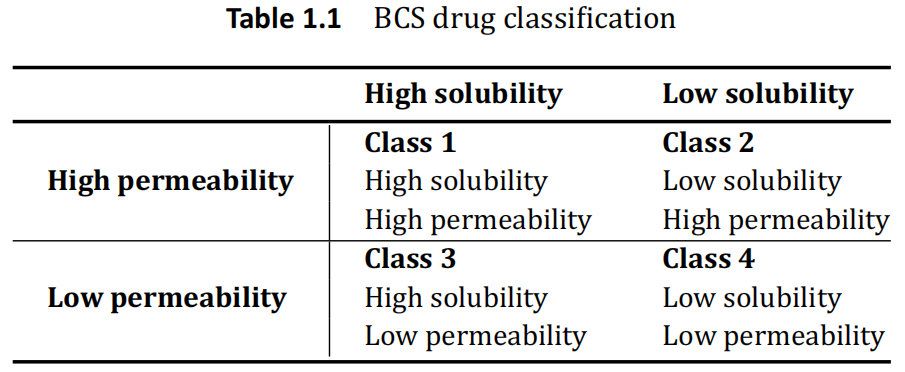
根據FDA指南,當在1至7.5的 pH范圍內最高劑量規格可溶于<250mL水性介質時,目標藥物被認為是“高溶解性的”。如果將人體吸收的程度確定為施用劑量的>90%,則該藥物被認為是“高滲透性的”。此外,當使用USP 1或2,并在體積<500mL緩沖介質,在 15分鐘內>85%標示量的藥物溶出時,藥物制劑被認為是“快速溶出”。
了解藥物的 BSC類別允許制藥科學家評估吸收藥物的限速步驟。對于 BCS1類藥物,API是高溶解度和高滲透性的,表明胃腸道中的吸收應溶出速率限制的。對于 BCS2類藥物,由于藥物溶解度較低但滲透性高,因此該類藥物也應溶出速度受限。由于 3類溶解度較高,藥物滲透性較低,因此該類API的吸收率受到限制。對于這類藥物,溶出在臨床上很少有相關性。FDA最近發布了一個指南,指出在特殊情況下,第3類藥物可以按照生物豁免研究的1級規格進行處理。然而,本指南并沒有提出通過傳統溶出度測試,可以輕松實現 BCS 3類藥物的 IVIVC。對于 BCS 1類和3類藥物的IVIVC是不可能的,除非由于制劑(例如MR制劑)而導致藥物溶出明顯減慢,或化合物溶解度在 BCS1類的邊界附近。FDA對速釋固體口服劑型溶出度測試指南中承認,BCS4類藥物依賴轉運蛋白和其他生物手段在膜上運輸。溶出可能能夠表征這種運輸,但是與 BCS 3類藥物一樣,溶出被用來表征這些藥物的吸收。
2.2 難溶性藥物
本書的一個主要重點是著重于 BCS 2類藥物的溶出和藥物釋放。這些藥物是高滲透性的,但溶解度有限。截至 2006年,BCS第2類藥物占全球制藥市場的三分之一。第5章將說明,制劑技術在提高這些分子的生物利用度方面已經有很大的進展。通常,這些制劑通常使用無定形或納米顆粒材料技術。
三、溶出市場
溶出是在每個主要藥物業務實驗室中發現的口服劑型的重要技術,主要使用色譜和光譜進行最終定量分析。因此,或許是時候在本科儀器分析教科書中加入一章溶出度測試。2009年,約3400臺儀器出售,市場預計年增長率為8%。今天,該市場價值超過1.5億美元,直接與制藥市場相關。制藥業約占這些銷售額的 75%。其余 25%分為合同研究機構,生物技術學院,學術界和農業部門。
如圖1.1所示,質量控制測試主導了溶出度測試的需求。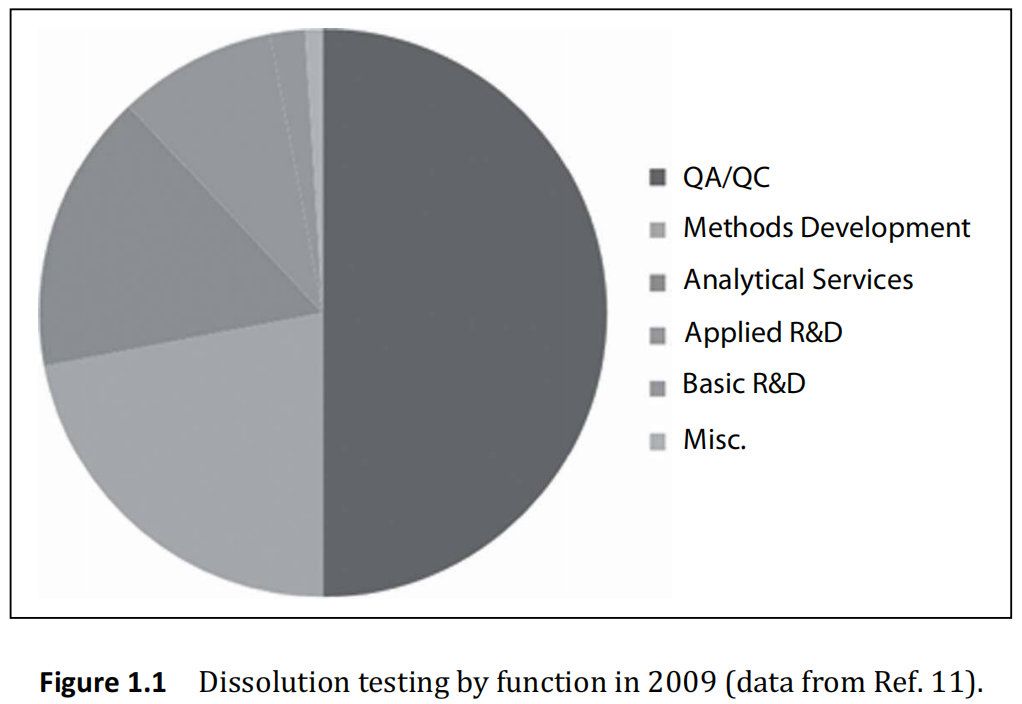
如圖1.2所示, 2009年,最大的溶出供應商是 Varian/Agilent。供應商的市場多元化;然而,即使有這種多樣性,今天的技術仍然圍繞USP指定1法和2法的標準,市場上儀器3和4的部分不太重要。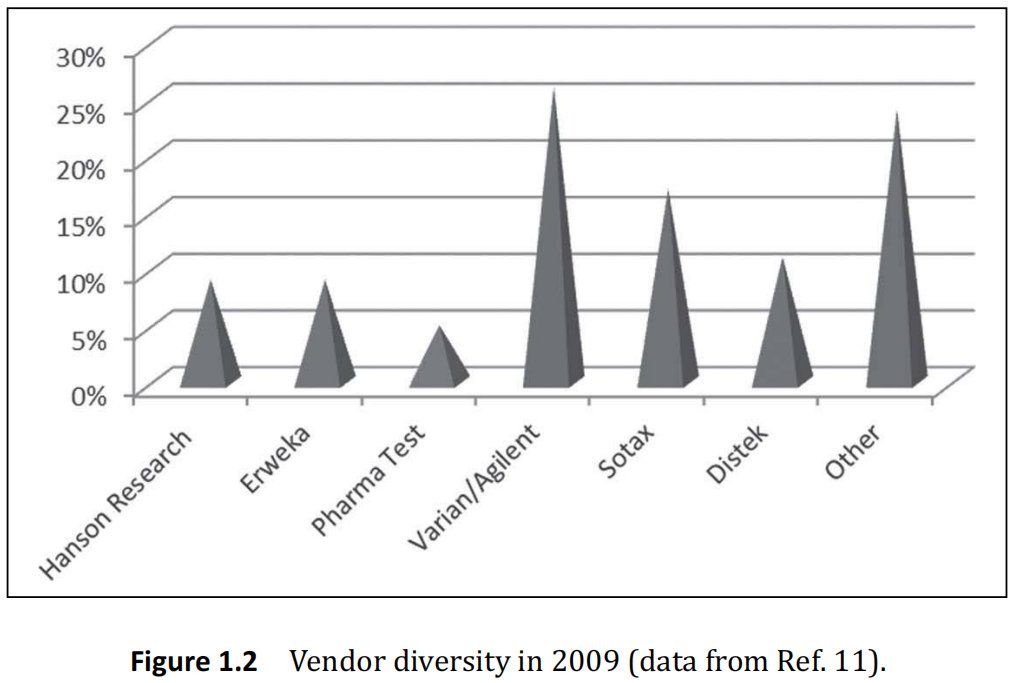
然而,正如第8章和第9章所述,這些儀器技術可能在未來幾年的溶出和藥物釋放測試中發揮更重要的作用。
四、制藥中的溶出及藥物釋放
本文的目的是為該領域領先的科學家討論目前將溶出和藥物釋放應用于難溶性分子的應用。每一章都提供了所提供材料的主要從業人員的最新觀點。盡管溶出度和藥物釋放的許多儀器并沒有從傳統的USP儀器上發生巨大的變化,但隨著不斷變化的分子被推向市場,這些方法和應用已經向前發展。本書建立在從最初和早期發展的技術上。有關溶出度和藥物釋放的發展和理論的細節可以在文獻中找到。
4.1 藥物 API 的溶解度測定
最終制劑中活性藥物成分(API)的水溶性是影響藥物的藥代動力學特征的重要因素。有各種分析方法和預測 API溶解度的計算模型。在體內的溶解度,常常與通常用于藥物質量控制過程的體外緩沖液體系中測定的不同。計算模型的質量也受實驗溶解度數據的準確性影響。高通量發現過程推動了高通量篩選過程的開發,用于測量物理化學性質,包括脂溶性,pKa和溶解度,但是這些方法的準確性常常受到速度的要求和在測定中非生物相關介質的使用的影響。來自哈德斯菲爾德大學的 Kofi Asare-Addo和 Barbara R. Conway 將討論關于 API的溶解度測定的細微差別。
4.2 在溶出度測試中使用表面活性劑
制劑的任何相關的溶出或藥物釋放測試之前,分析目標必須溶解在測試介質中。在溶出試驗中,通常通過向溶出介質中加入表面活性劑來實現。表面活性劑的主要目標是在溶解后將目標分析物保持在溶液中。表面活性劑還通過降低介質中的表面張力來幫助材料潤濕。然而,理想地,表面活性劑不應該通過加速藥物制劑本身的溶解或侵蝕來改變釋放的機制。Zydus的Amit Gupta 回顧了在溶出介質中使用表面活性劑,以將該技術擴展到難溶性藥物。
4.3 難溶性藥物的固有溶解速率評價
圣保羅大學的 Michele Georges Issa 和 Humberto Gomes Ferraz討論了固有溶解度測定及其在難溶性藥物評價中的應用。他們討論了最常用的設備和固有溶解速率 (IDR)的計算,以及應用的一些相關實例和該方法的變量, 和實驗設計的使用的簡要說明。在藥物化合物開發的所有階段(從新化學實體的合成直到 API開發的質量保證) 中應用 IDR,科學家們可以更好地理解使用相對少量的材料來選擇最佳生物利用度的主要候選參數的關鍵參數。
4.4 口服不良溶解藥物的策略
在過去幾十年中,組合化學和高通量篩選的發展,使得能夠發現新的化學實體(NCE)以用于各種復雜和多樣的生物學靶標。許多生物靶點本質上是高度親脂性的或疏水性的,并且水溶性差的 NCE數量明顯增加。雖然口服給藥仍然是NCEs最常用的給藥途徑,但水溶性較差會導致明顯的開發挑戰,如吸收不完全,生物利用度高度變化,以及臨床前物種和人類藥物動力學差異大。現在可以使用許多常規和有利的制劑技術,來解決溶解性差以及由此導致的NCE的生物制藥性能差的問題。然而,在發現過程中通常沒有對最佳制劑技術進行系統的評估和主動選擇, 而且由于生物制藥不佳以及缺乏足夠的臨床前安全評估暴露,許多有希望的 NCEs被終止。本章的目標是描述一個系統的方法,用于生成一個交叉功能的數據包,包括物理化學,生物制藥,ADME,PK/PD和輸送技術評估,以口服遞送水溶性差的 NCEs。Akash Jain, Dev Prasad 和 Sudhakar Garad 討論了從臨床前到商業開發中將可溶性分子配制成可行劑型的一般概念。
4.5 藥物溶出度測試的分期方法
隨著目標分子從發現到藥物開發的各個階段,溶出方法的應用也在不斷發展。隨著有關藥物及其選定劑型的更多信息的了解,溶出方法性能的預期也隨之增加。在臨床開發的第2b/3階段后期,溶出方法應該是其最終形式。對臨床試驗和生產歷史的結果進行審查,以提出商業上市材料的相關規范。GregoryWebster, Paul Curry 和 Abb Vie 的Xi Shao 回顧了溶出方法的發展, 因為藥物運輸貫穿了藥物開發的各個階段。
4.6 兩相體外開發與應用
包含水相和有機相的兩相溶出測試被設計為比具有“吸收環境”的常規單相溶出測試更具生理學相關性。這是體外試驗模擬藥物溶出和分配到腸膜的動力學過程。本章報道的案例研究表明,與傳統的單相溶出方法相比,這種兩相溶出度試驗為建立幾種藥物(包括速釋和延長劑型)的體外和體內關系(IVIVR)提供了更好的機會。特別是,兩相溶出試驗可能非常有用地評估 BCSⅡ藥物的亞穩態過飽和狀態,包括過飽和的持續時間和程度,聚合沉淀抑制劑的作用以及藥物分布的總體效應。另外,還討論了重視藥物分配動力學的兩相溶出系統的理論模型。Abb Vie 的Gao Ping, Yi Shi 和Jon Miller 回顧了雙相溶出在難溶性藥物中的應用。
4.7 在難溶性藥物制劑的溶出度測試中使用儀器3
USP3,往復筒最初設計用于測試延長釋放產品并使藥物制劑暴露于與胃腸道中發現的相似的藥代動力學和機械性質。該儀器已被證明對難溶性化合物,咀嚼制劑,速釋,延遲釋放和許多改良釋放產品有用。在寫這篇文章的時候,往往需要對透析膜內的微球進行適應性評估,這樣可以為生物相容性藥物釋放微粒和納米粒子提供額外的好處。由于該儀器能夠表征早期藥物制劑候選物的釋放特征,該裝置有可能為通過質量源于設計(QbD)理念開發的制劑提供基于知識的評估,并進一步表征產品設計空間,用于批準后制造。
4.8 在難溶性溶解藥物制劑的溶出度測試中使用儀器4
Sotax的 Geo ff rey N. Grove 與康涅狄格大學的 Rajan Jog和 Diane Burgess一起簡要介紹了 USP 4技術的發展歷程、藥典考慮因素和監管考慮因素,以幫助為何時選擇 USP4奠定基礎。它還涵蓋了各種不同系統配置和流通池選擇和設計的概述,涵蓋了藥典和非藥典設計選擇。它進一步提出了諸如泵選擇和流速等考慮因素的方法參數,并強調了可能與難溶藥物相關的選擇。
本章還對受檢藥物進行了全面的綜述,包括文章標題,儀器和系統設計說明。總結了包括介質類型,過濾器類型,流量和各種其他參數在內的實驗條件,重點在于選擇 USP4的結果的相關性。作者希望對目前的文獻進行回顧將是有用的參考和決策工具。
4.9 納米顆粒藥物制劑的溶出度
Shire LLC的 John Bullock 討論了與納米顆粒藥物制劑的溶出相關的許多挑戰中的一些。在過去幾十年中已經開發了許多類型的基于納米顆粒的藥物制劑技術,以便為治療和診斷劑提供一系列不同的增強的藥物遞送特性。在口服藥物遞送領域中,最常見的納米顆粒結構可以分為純藥物納米顆粒,其由基本上 100%的藥物或各種不同的納米尺寸結構組成,其中活性藥物包封或分散在固體,半固體,或制劑基質內的液體狀態。不管這兩種類型的藥物納米顆粒中的哪一種以口服劑型使用,遇到的基本挑戰和開發用于測量藥物釋放的合適技術的方法通常與純藥物納米顆粒和基質型納米顆粒制劑相似。這些納米顆粒制劑的溶出方法的兩個更明顯的特征包括,在適當取樣和處理含有小納米尺寸藥物顆粒的溶出樣品中遇到的挑戰,以及與用常規尺寸的藥物顆粒制備的制劑相比具有更快的溶出速率的潛力。本綜述首先簡要討論了控制藥物顆粒的溶解度和溶出度的理論基礎,以及對納米尺寸藥物顆粒更為重要的某些考慮,重點是純藥物納米顆粒。在討論之后,提供了引導從業者開發合適方法的實用指南,其中包括所使用的溶出介質的考慮因素,儀器考慮以及已被證明對許多不同類型的納米顆粒制劑成功的取樣和處理方法。
結合對儀器考慮的討論,綜述了最近出現的各種原位分析技術,并且證明了快速溶出的納米顆粒制劑的溶出測試的優點,并且已經描述了用于評估納米顆粒性能的一些替代的體外釋放技術檢查藥物制劑。
4.10 基于脂質的藥物制劑的溶出
來自Boehringer Ingelheim的Stephen Caffiero描述了基于脂質的藥物制劑的一般性質及其溶出行為。用于體內吸收的藥物可用性,可以通過溶解在膠體分散體中的藥物的呈現來增強。越來越多的難溶性藥物在親脂性基質中配制,這個行業趨勢已經導致了美國藥典(USP)專家組的合作,這些專家組編寫了通用章節(通用章節 USP <1094>液體填充膠囊溶出測試和相關質量屬性),特別關注這些制劑的溶出度測試,還有相關議題,如膠囊破裂測試,乳劑液滴大小的確定和案例研究,將在此進行討論。
4.11 穩定無定形藥物制劑的溶出
Banner Life Sciences 的Justin Hughey 討論了溶出測試在表征穩定化無定形藥物制劑(SADF)中的關鍵作用。無定形系統在口服BCS 2類藥物中繼續是重要和不斷增長的技術。使用高能形式的藥物物質,例如無定形形式,與沉淀抑制性賦形劑相結合已被證明是增加溶解度和生物利用度的有價值的策略。本章解釋了化學,物理形態,功能賦形劑,過飽和度和熱力學的相互作用在溶出測試中如何融合,以深入了解與 SADF 相關的溶液介導的傳質和相變現象。
在說明性案例研究中討論了藥物輸送系統設計,溶出方法參數,介質選擇以及漏槽和非漏槽條件的細微差別等基本考慮因素。這些研究清楚地表明了溶出和沉淀測試在理解和推進這種重要的藥物遞送方法方面的力量。
4.12 混懸制劑的溶出
混懸劑由分散于液體介質中的不溶性固體顆粒組成。開發混懸劑的最常見原因是活性藥物成分(API)在所需劑量下的水溶性是有限的。使用混懸的另一個常見原因是與溶液相比,它們通常提供改善的化學穩定性。混懸劑還提供了味道掩蔽和某些患者(例如,小兒科)的更方便的劑型的優點。在本章中,輝瑞公司的 Michele Xuemei Guo, Kenneth Norris和 Ling Zhang著重于通過口服給藥途徑給藥的劑型中的混懸制劑的溶出和藥物釋放,包括口服混懸劑,用于重建的混懸液和膠囊中的混懸液。
4.13 生物相關溶出
輝瑞公司的Mark McAllister和Irena Tomaszewska 在生物相關的溶出條件下討論測試難溶性藥物。一般來說,用于改善溶出度測試的生理相關性的方法可以大致分為兩組。第一組包括機械方法,其中控制溶出過程的單個方面以研究諸如介質或流體動力學的生理變量的影響。第二組包括設計用于模擬胃腸道多個方面的方法和設備,并提供包含流體,消化,轉運和吸收的腔內條件的整體模擬。應當認識到,對于劑型或API溶出的特定方面,機械(還原劑)方法可以允許詳細評估個體現象,例如過飽和度,沉淀和再溶解。相比之下,整體模擬方法考慮了多個過程(如消化,轉運和吸收)對劑型表現的總和或凈效應,例如在評估復雜的食物效應時。本章介紹了機械和整體方法的生物相關溶出測試的開發,并評估了在溶出測試中對介質(組成和體積),流體動力學和吸收組分的整合修飾的生物相關性。
4.14 低溶解度速釋產品的臨床相關溶出度
AstraZeneca的Paul Dickinson, Talia Flanagan, David Holt 和Paul Stott討論了低溶解度速釋產品的臨床相關溶出情況。他們提出了一個結構化的開發方法,努力確定和評估臨床表現的風險,并在適當的情況下,測試體內這些風險的影響。每一種化合物都應該根據其自身的優點加以考慮,但是采用提議的5步法將確保考慮所有重要的因素, 并最終導致建立一個強有力的控制策略。這種方法的好處包括增強產品供應的安全性,優化制造工藝的能力,并展示任何提議的變更的(缺乏)影響,以及改善對患者提供的產品臨床質量的保證。預期溶出度測試及其相關規范可以用于許多目的,因為區分力的要求和完全釋放的演示可能會發生沖突。如果我們要實現更具臨床相關性的溶出指標的全面好處,就需要進一步開展科學的理解和監管協調工作。作者們相信,在 QbD的支持下提出的增加知識和理解的開發是基于對體內表現的洞察和控制。
4.15 BCSⅡ/Ⅳ類產品溶出度測定方法驗證和 QbD
葛蘭素史克公司的 Alger Salt 討論了 QbD方法開發和驗證溶出度測試方法。QbD原則為產品、技術和流程的開發和交付提供了結構化的方法。歷史上,QbD一直針對制造工藝和產品屬性。QbD原則現在正在應用于分析方法。方法轉移是成功的產品生命周期的一部分,因為R&D中開發的工作最終被轉移到制造場所的QC 實驗室。
在采納 QbD原則之前,分析人員學習(并多次重新學習)分析方法的問題經常在方法轉移過程中發現。現在不是發現這種問題的好時機,因為通常很難對方法進行修改,修復這些問題可能令人沮喪,而且費用昂貴。
1.設計意圖
2.設計選擇
3.控制定義
4.控制驗證
4.16 BCSⅡ類/Ⅳ類產品的藥物釋放測試中的監管注意事項
藥物與生物技術開發的 Robert Bell 和武田藥業的 Laila Kott 總結了目前的指導原則,以及它們與低溶解度化合物的關系。我們回顧儀器的歷史和進展,以及指導文件的演變。介紹了用于描述所有類型化合物的三個分類系統的總結。分類系統包括 1995年出版的 1995年藥物產品生物藥劑學分類系統(BCS), 2005年出版的生物藥劑處置分類系統(BDDCS)和2010年首次提出的可開發性分類系統(DCS)。
介紹了關于使用生物相關介質進行制劑開發的適用性及其用于質量控制(QC) 測試的可能性的討論。討論和剖析了關于這一主題的指導原則。其中包括與目前的指導意見和行業趨勢有關的溶出指標的設定。最后,總結了當前的關鍵指導文件和新興的監管議題。
4.17 膠囊制劑的溶出度
配制在液體填充膠囊中用于吸收的化合物的可用性,取決于膠囊殼的初始溶解和破裂,并隨后其填充內容物在 GIT 液體中的釋放和溶出。這兩個過程需要在釋放時和膠囊產品的保質期內進行監測。由于殼體和填充材料的復雜性質,液體填充膠囊在開發和應用溶出方法期間提出了獨特的挑戰。外殼材料容易發生其機械性能的變化或明膠的交聯,這導致其溶解度的變化。另一方面,填充材料可以在混懸液填充物中,顯示出懸浮物質的粒度分布或多晶型性質,或溶解填充物中的可溶性化合物的結晶的變化。在后一種情況下,溶解的化合物的結晶,可以在膠囊劑型,或在填充材料遇到體外和體內含水流體時發生。
溶出度測試是體外表征液體填充膠囊產品的非常有價值的工具,常規用于
(a)評估批次間質量,
(b)監測產品在其保質期內的質量變化,
(c)在擴大規模和批準后變更(SUPAC)后評估產品相同性,
(d)符合生物豁免要求, 降低產品規格;
(e)符合生物豁免要求,用于在本地采取行動的產品 GIT。
此外,設計用于產生體外/體內相關性(IVIVC)或體外/體內關系(IVIVR)的溶出方法可用于預測產物之間潛在的生物等效性或生物不等效性。Dart Neurosience LLC的 Rampurn a Gullapalli寫的這一章的目的,是對影響液體填充膠囊產品的體外和體內溶出的因素進行深入討論,開發其常規QC 測試的溶出方法,以及對這些方法產生潛在的 IVIVC和IVIVR。
4.18新興和非藥典釋放技術
常規和非常規劑型的溶出度檢測是在二十世紀六十年代引入的,現在作為一項必不可少的藥典試驗,由所有藥典用于評估藥物釋放。除了標準化測試外,還有幾種非藥典方法被合格和驗證用于藥物釋放測試。
本章分為三個部分。第一部分簡要討論現有的藥典方法以及任何非藥典方法。第二部分描述了不同類型劑型的非臨床儀器。最后一節將介紹各種檢測技術,如使用拉曼光譜, FTIR-ATR和光纖的 UV成像。康涅狄格大學的 Namita Tipnis 和Diane Burgess提供他們對藥物實驗室溶出和藥物釋放測試的新興技術評估的回顧。
五、參考文獻
略
如需原文,請聯系小編(15012941165)