時間:
 翻譯:華溶應用中心
翻譯:華溶應用中心
審核:工業藥劑發燒友
體外藥物釋放測試和體外經角膜藥物滲透可以在動物研究之前提供Q1/Q2等效軟膏性能的有價值信息。體外和離體藥物釋放的良好相關性可能表明體外和體內的良好相關性。因此,研究Q1/Q2等效眼膏的體外和離體藥物釋放,并評估是否可以建立這些釋放曲線之間的相關性具有重要意義。我們使用來源不同的賦形劑和加工方法,制備了4種Q1/Q2當量氯替潑諾眼膏。測定4種制劑的流變學參數(交叉模量和K值)。使用3種不同的儀器(Franz擴散池、USP 2浸沒池裝置和USP 4半固體適配器)進行4種軟膏制劑的體外藥物釋放試驗。采用三種模型(零階模型、對數模型和Higuchi模型)研究軟膏制劑的體外釋放動力學。采用Franz擴散池對兔角膜進行透角膜研究。USP 4法較USP2法和Franz擴散池法具有更好的鑒別能力。使用Higuchi模型(R2> 0.98)對4種不同制造方法的Q1/Q2等效軟膏的體外釋放曲線進行了分析,結果3種測試方法的擬合度均優于其他2種模型。藥物通過兔角膜的體外釋放表現為零級釋放動力學。流變學參數(交叉值和K值)與經角膜通量呈對數相關。此外,4種軟膏制劑的體外釋放率與體外釋放通量的曲線顯示,3種釋放方法的釋放率均呈直線(R> 0.98)。因此,流變學參數可用于預測軟膏的體外和離體釋放特性。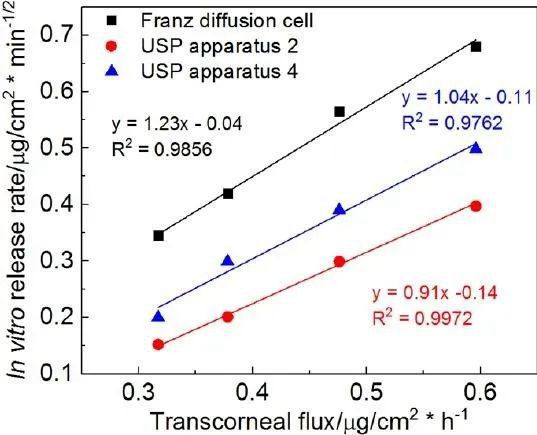
由于藥物在角膜表面的滯留時間短、在角膜前迅速消失,藥物的生物利用度低,限制了眼局部給藥。在滴眼液后,高達95%的藥物會由于流淚和非生產性吸收而丟失。人們已經做出了巨大的努力來提高眼部藥物的生物利用度,使用不同的機制,如原位凝膠,接觸鏡,黏度增強劑和黏液黏合劑。然而,迄今為止,傳統劑型(如滴眼液、懸液和眼膏)仍然是治療眼部疾病的主流劑型,約占FDA批準的市售眼局部藥物的97%。在已上市的眼用劑型中,眼膏(主要是油型)約占10%,僅次于眼用滴眼液。與其他常規眼局部劑型相比,傳統的油狀眼膏在眼表停留時間較長,給藥頻率較低,患者依從性較好,是首選的眼膏。然而,目前對眼膏的劑型設計和加工,以及眼膏的體外、離體和體內性能缺乏了解,涉及這些方面的最新文獻較少。
根據FDA指南,關鍵質量屬性(CQA)是一種物理、化學、生物或微生物性質或特征,應在適當的限度、范圍或分布內,以確保所需的產品質量。cqa通常與原料藥、輔料、中間體(中成品)和藥品相關。劑型的cqa通常是影響原料藥純度、穩定性和藥物釋放的方面。了解藥品的關鍵質量屬性及其對產品性能的影響對于促進生產和監管審查以實現可重復和安全的藥品至關重要。在定性(相同成分)和定量(相同濃度的相同成分)(Q1/Q2)等效配方的制造中,據報道,微小的制造變化(例如,制造地點變化,在加工中使用的不同溶劑,賦形劑等級和來源等)可能會導致在體外和體內表現有顯著差異。因此,開發能夠區分具有生產差異的制劑的體外溶出方法非常重要。
為了進一步了解關鍵屬性如何影響具有生產差異的Q1/Q2等效眼用制劑的體內性能,最好的方法是進行體內研究。然而,這些研究耗時、昂貴且需要大量的動物。另一方面,體外或離體模型在研究眼內滲透和吸收方面更經濟和更符合倫理。這樣的模型在初步配方開發過程中可能特別有用。最近對常用的的體外和離體模型進行了綜述。由于兔眼的解剖結構與人眼最相似,因此兔眼模型是體內和離體角膜研究的首選模型。被動擴散的藥物,體外滲透和體內吸收之間具有良好的線性相關性(r2 = 0.95)。藥物釋放的良好的體外相關性可能表明良好的體內外相關性。
本研究對氯替潑諾眼膏進行研究。氯替潑諾是第一代皮質酸軟性類固醇之一,廣泛用于眼部炎癥性疾病的治療。在生理條件下,氯替潑諾產生治療作用后轉化為非活性代謝產物。與其他糖皮質激素相比,氯替潑諾的軟藥設計使其毒性更小,治療指數更高。迄今為止,美國食品藥品監督管理局(FDA)批準的氯替潑諾眼用制劑有3種(0.5%或0.2%的混懸液、0.5%的軟膏和0.5%的凝膠),即Lotemax?(博士倫公司),用于治療眼部手術后的疼痛和炎癥。之前的報告顯示氯替潑諾眼膏的關鍵質量屬性(交叉模量和K值)與體外藥物釋放率之間存在較強的對數相關性。
本研究的目的是研究cqa對體外經角膜通量的影響,以及體外藥物釋放和離體藥物釋放之間的關系。
使用球形Franz擴散池對四種具有制造差異的氯替潑諾Q1/Q2等效制劑的經角膜藥物滲透進行研究。因此,我們將嘗試將物理化學性質與Q1/Q2等效制劑的體外和體外藥物釋放之間的關聯,以及體外和體外藥物釋放之間的關聯。此外,本文還將對該軟膏的體外釋藥機制進行研究。我們將利用三種不同的方法(Franz擴散池,帶有浸沒池的USP2和帶有半固體適配器的USP4裝置)的體外藥物釋放數據。使用三種常用模型(零階動力學模型、對數模型和Higuchi模型)評估Q1/Q2等效軟膏的體外藥物釋放動力
2.1材料
氯替潑諾(粒徑:19 μm)購自美國Pure Chemistry Scientific公司。兩種不同來源的白色礦脂分別購自Fisher?和Fougera?。礦物油,購自美國。氯化鈉,氯化鈣,十二烷基硫酸鈉(SDS),購自Sigma-Aldrich,美國。碳酸氫鈉購自Fisher?,美國。羥丙基-β-環糊精(HP-β-CD)購自山東濱州致遠生物技術有限公司。除特別說明外,所有材料均為分析級。
2.2氯替潑諾軟膏的制備
氯替潑諾軟膏(藥物含量:0.5% w/w)為Q1/Q2當量,按照之前報道的制備。簡而言之,將白色礦脂(69.2% w/w)、API (0.5% w/w)和礦物油(30.3% w/w)的混合物(批量大小:50克)添加到塑料罐中(Unguator?)。使用三種不同的制造方法對混合物進行加工,包括:1)65℃熱熔和混合,并在-20℃冰箱中立即冷卻;2)在65℃熱熔并在室溫下混合冷卻;3)室溫下簡單混合。混合的攪拌速度(Unguator?e/s混合器,GAKO?International GmbH)為1,450 rpm,簡單混合和熱熔方法的混合時間分別為6和5分鐘。使用兩種不同來源的白色礦脂(Fisher?,Fougera?)制備氯替潑諾眼膏制劑。4個Q1/Q2當量眼藥膏。制備了具有不同制造工藝的軟膏配方,并列于表1中。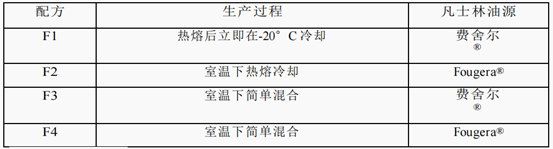
2.3HPLC 分析
采用 PerkinElmer Flexar 高效液相色譜法測定氯替潑諾的濃度,紫外檢測器設置在 244 nm。流動相為乙腈-水-乙酸(65.0/34.5/0.5,v/v/v)Zorbax?Eclipse XDB-Phenyl C18 (250 × 4.6 mm, 5 μm;Agilent Technologies, USA)色譜柱,流速為 1 ml/min,柱溫設置為 30℃。將 50μl 樣品注入HPLC中。色譜分析采用 Chromera V3.0軟件。該方法在0.02 ~ 1.00 μg/ml(R2=0.99)和0.10~5.00μg/ml(R2= 0.99)濃度范圍內有良好的線性關系。2個濃度范圍均具有良好的日內和日間精密度RSD(%)均< 2.0。
2.4流變學表征
使用流變儀(ARES-G2, TA Instruments, USA)和20 mm AL ST板對氯替潑諾軟膏的流變特性進行表征。將約0.3 g軟膏放置于下板上。將幾何間隙設定為1000μm。將預處理步驟的溫度設定在37℃。執行45 min時間掃描步驟以使樣品完全從樣品制備期間施加的剪切中恢復(在振蕩應力0.1 Pa和0.1 Hz振蕩頻率下監測。然后進行應力掃描步驟,振蕩應力從0.1變化到25 Pa,同時保持頻率為0.1 Hz。在上述相同的時間掃描步驟之后,進行穩態流動步驟,剪切速率(?,1/s)從10-4 到103 s-1。以對數模式(每10年收集2點)測量樣品的粘度。在測量過程中,每個點的%公差設置為5.0%。所有樣本均重復測量3次。
2.5體外釋放試驗
采用Franz擴散池、USP2和USP4 三種釋放試驗方法考察氯替潑諾軟膏的體外釋放情況。在pH值為7.4的人工淚液(含0.67% (w/v) NaCl、0.2% (w/v) NaHCO3和0.008% (w/v)CaCl2·2H2O)中,使用0.5% SDS(w/v)在37℃進行釋放測試。人工淚液使用醋酸纖維素膜(Sartorius?,平均孔徑為0.45 μm),在Millipore水中保存30分鐘后進行藥膏加載。每隔0.25、0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0 h取一定量樣品,加入新鮮介質。
2.5.1 Franz擴散池
使用容積為12 ml的垂直Franz擴散池(接觸面積:1.77 cm2, PermeGear Inc.)。在添加釋放介質后,將醋酸纖維素膜放置在池的受體室的頂部。然后將供體室安裝在池膜上并夾緊。取150 mg軟膏樣品裝入供體室,并在軟膏頂部加入250 μl釋放液,模擬眼表分泌的少量淚液。Franz擴散池的攪拌速度設定為600 rpm。在預定的時間間隔內,從受體室中抽出0.15 ml介質并補充新鮮介質。
2.5.2帶有浸沒池的USP2
將浸沒池(表面積:4 cm2)與配備200 mlUSP2法溶出杯一起用于測定氯替潑諾軟膏的體外釋放特征。將50 mg軟膏樣品填充到浸沒池的隔室中。為了防止藥膏表面和膜之間的膨脹或空氣夾留,使用一種薄的塑料工具將藥膏表面壓平。將醋酸纖維素膜置于軟膏樣品表面,按照制造商的說法組裝池。將組裝好的浸沒池置于溶出杯底部且膜朝上并且隨后添加預熱的(37.0±0.5℃)介質(40 ml)開始測試。使用迷你槳葉將攪拌速度設定為150 rpm。在預定的時間間隔,取出1ml樣品,并補充等體積新介質。
2.5.3 USP儀器4帶半固體適配器
使用半固體適配器(暴露面積1.54 cm2)與USP4 進行氯替潑諾軟膏的體外釋放試驗。將氯替強諾軟膏(約330 mg)填充到適配器儲存器(深度:2.6 mm)中,并用一個薄的塑料工具將儲存器表面壓平,以避免軟膏表面和膜之間的空氣夾留。將醋酸纖維素膜置于樣品隔室的表面上,并按照制造商的說明組裝適配器。將膜朝下的適配器裝入預充有14 g 玻璃珠(直徑1 mm)的流通池(直徑22.6 mm)中。在37℃下以8 ml/min的流速使50 ml釋放介質通過該流池循環。在預定的時間間隔,取出1 ml釋放液并補充新鮮培介質。該方法是我們實驗室開發的,以實現對具有制造差異的眼膏配方的區分(圖1)。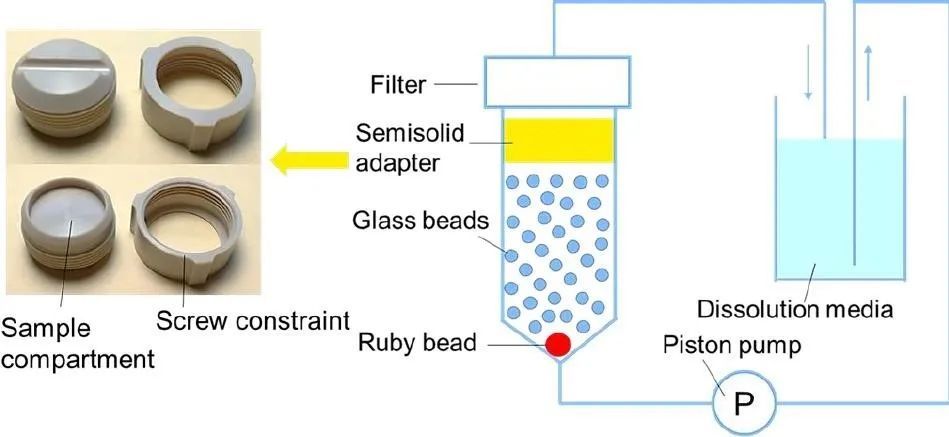
圖1所示。半固體適配器的照片和USP4儀器的示意圖,以及用于眼膏釋放試驗的半固體適配器。
2.6離體經角膜滲透性
使用帶有球形關節(直徑:9 mm,面積:0.64 cm2,體積:5 ml)的Franz擴散池(PermeGear公司,Hellertown, PA)(圖2)來研究軟膏制劑的經角膜滲透性。使用OpTMtisol-GS作為兔角膜的儲存介質,Optisol-GS是用于保存角膜移植中供體角膜上皮的儲存介質。將切除的兔角膜(peli -freez Biologicals, Rogers, AR)儲存在OptisolTM-GS角膜儲存在4°C介質(博士倫公司,NY)中。角膜在這種介質中用冰運輸,并在接收后在4°C儲存。所有實驗均在3天內完成。在pH 7.4 的含9%(w/v)羥丙基-β-環糊精(HP-β-CD)的人工淚液中,在34℃下進行經角膜滲透性實驗。向受體室中加入5 ml滲透介質,攪拌速度設定為600 rpm。將帶有鞏膜的兔角膜(白色部分)修剪到合適的大小,用pH值為7.4的PBS沖洗3次,然后安裝到受體室的球形關節上。角膜的放置使其外部面向供體室。使用了一個鋼夾收緊兩個腔室受體腔內介質與角膜之間的任何氣泡都被排出。供體室中加入200 μl滲透性介質使角膜平衡10 min。然后從供體腔中去除平衡介質,并通過吸收到紙巾上去除任何殘留介質。將約200 mg軟膏分配至供體腔中并使用分配尖端(Unguator?)使其變平。將100μl滲透介質添加至供體淚室以模擬人眼排出的淚液。觀察不同濃度的含9% (w/v) HP-β-CD的pH值為7.4的人工淚液對角膜的滲透性。分別向供液室中加入1 ml濃度為8.80、17.20和35.70μg/ml的藥液。用旁膜覆蓋供體腔,防止水分蒸發。在預先設定的時間間隔(加樣后0.5、1.0、1.5、2.0、2.5、3.0、4.0 h)抽取樣本。
圖2。用于經角膜滲透研究的球形關節Franz擴散池的攝影圖像。
2.7 兔角膜上皮的完整性
在離體經角膜滲透實驗前后檢查兔角膜上皮層的完整性。將角膜組織用10%的福爾馬林緩沖液(磷酸鹽緩沖液)固定并包埋在石蠟塊中。蘇木素-伊紅(he)染色觀察各組大鼠角膜組織病理學改變;角膜切片組織切片采用Olympus BX51光學顯微鏡(Olympus America Inc.)觀察。使用SPOT IMAGINGTM software(Diagnostic Instruments, Inc.,New York)進行圖像采集。美國MI)。
2.8統計分析
采用Bonferroni 's檢驗比較各參數的均數差異。p< 0.05為顯著性差異。Wilcoxon秩和檢驗、Mann-Whitney秩和檢驗用于比較體外和體外釋放測試方法的區分能力。采用OriginPro 2017軟件(OriginLab Corporation)進行線性回歸和擬合。
3.1氯替潑諾軟膏的流變學特性
根據之前的報道,氯替潑諾半固體制劑的兩個關鍵流變學參數是交叉模量(CM)和冪律一致性指數(K值)。交叉模量是在存儲模量G’等于損耗模量G”的點上獲得的,當與振蕩應力作圖時(圖3)。K值是根據公式的流變圖使用Power law方程獲得的。研究表明,兩個關鍵參數(交叉模量和K值)和Q1/Q2等效軟膏制劑的體外藥物釋放之間存在很強的對數相關性。因此,在處方篩選過程中,交叉模量和K值可用于預測Q1/Q2當量軟膏制劑的體外釋放率。
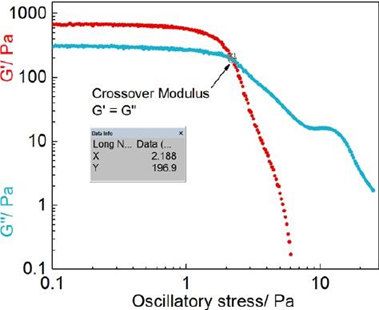
圖3。代表性(F2)應力掃描剖面(對數-對數尺度),通過對振蕩應力繪制G '和G "。
3.2 Q1/Q2等效軟膏的體外藥物釋放
采用Franz擴散池法、USP2浸沒池和USP4半固體適配器法對氯替潑諾軟膏進行體外藥物釋放試驗。Q1/Q2等效氯替潑諾軟膏的體外釋藥方法的建立和評估已在之前發表。結果顯示,與其他兩種體外釋放試驗方法相比,USP4法對生產差異的Q1/Q2制劑具有最好的區分能力。不同釋放方法獲得的軟膏制劑的體外釋放率均與關鍵理化參數(交叉模量和K值)呈對數線性關系。
基于四種Q1/Q2等效氯替潑諾軟膏的釋放特征,本文使用不同模型(包括零級動力學、對數模型和Higuchi模型)來研究使用不同釋放測試方法(Franz擴散池法(表2a)、具有浸沒池的USP2(表2b)和具有半固體適配器的USP4(表2c))獲得的氯替潑諾半固體軟膏的釋放動力學。Higuchi模型顯示對所有獲得的軟膏配方和所有三種釋放測試方法的最佳適合性。三種模型的擬合優度系數(R2)為:Higuchi >對數>零階。因此,軟膏的藥物釋放符合Higuchi模型,為擴散控制。
時間范圍的選擇以及時間點的個數可能會影響模型的擬合結果。采用不同的時間點和時間范圍(0.25 ~ 6 h)進行模型擬合分析。如果只考慮2小時及以上的時間點,則所有三種釋放測試方法的數據均由Higuchi模型變為對數模型或其他模型。對于儀器4的數據,所有4種制劑的0.25 h時間點均低于檢測限。此外,藥物釋放最慢的制劑(F1) 0.5 h時間點也低于檢出限。因此,為了公平比較,我們選擇了1 -6小時的時間范圍來進行模型擬合。
表2 a。氯替潑諾軟膏的藥物釋放曲線模型擬合(Franz擴散池法)。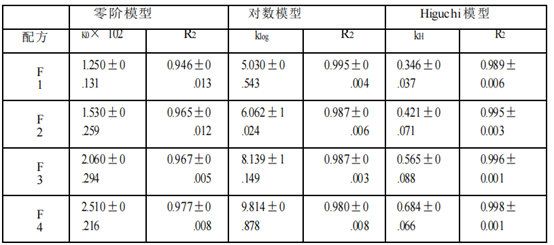
表2 b。氯替潑諾軟膏的藥物釋放譜模型擬合(USP2浸沒池法)。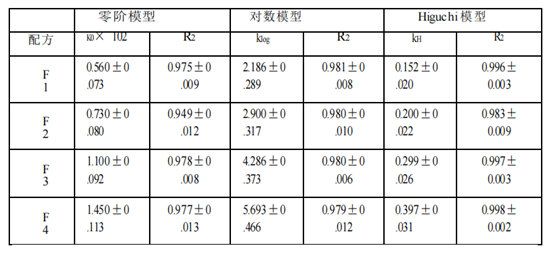
表 2 c。氯替潑諾軟膏的藥物釋放譜模型擬合(USP 儀器 4 和半固體適配器法)。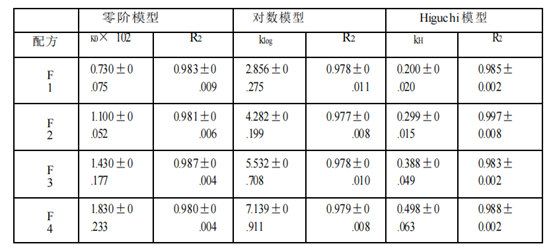
3.3 Q1/Q2 等效軟膏的離體藥物滲透性
3.3.1 氯替潑諾溶液的經角膜滲透性
采用兔角膜檢測 9%(w/v)HP-β-CD 配制的不同濃度氯替潑諾溶液的經角膜滲透性。所有藥物濃度均顯示出零級滲透動力學(圖 4A)和穩態經角膜通量(Jss)呈線性,與藥物溶液濃度成正比(圖 4B)。氯替潑諾表觀滲透系數(Papp)的計算公式如下21,22: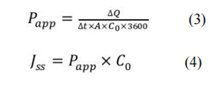
其中 ΔQ/Δt 是藥物在角膜上的累積滲透量(Q)隨時間的變化(t), A 是暴露的角膜表面積(本研究為 0.64 cm2 ), C0 是供體腔內藥物的初始濃度,3600 是從小時到分鐘的轉換,Jss是穩態 ss 的經角膜通量(累積滲透曲線的斜率在圖 4A 中)。氯替潑諾的經角膜滲透系數為 0.04 cm/h (1.11 × 10-5 cm/s)。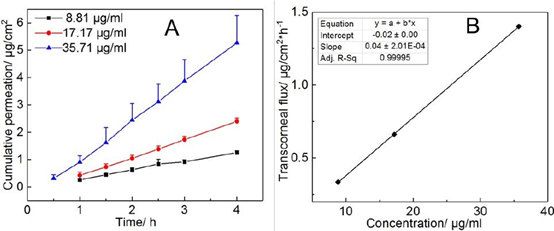
圖4。A)不同濃度氯替潑諾溶液的經角膜通透性;B)通過繪制跨角膜通量與藥物濃度的線性回歸曲線(n=3)。
3.3.2軟膏制劑的經角膜滲透性
氯替潑諾軟膏的離體經角膜滲透曲線顯示零級動力學(圖5A)。使用零級模型擬合獲得軟膏的藥物流量(圖5B)。F1和F3的經角膜通量之間有顯著差異(p< 0.05);F1和F4;以及F2和F4。比較兩種不同體外釋放方法與前兩種方法的鑒別能力體內滲透方法,Wilcoxon秩和、Mann-Whitney秩檢驗按照11進行。與之前觀察到的體外藥物釋放率相同,我們觀察到制造差異的軟膏制劑的經角膜通量。所有方法(三種體外釋放測試方法和體外滲透法)對四種軟膏配方均顯示出良好的區分能力(表3)。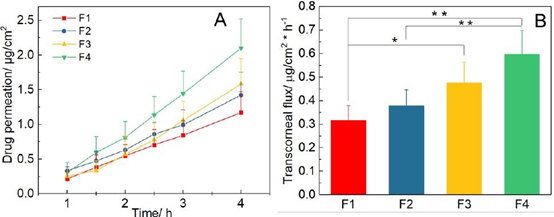
圖5。A)經角膜滲透曲線;B)使用球形關節Franz擴散池獲得的氯替潑諾軟膏的經角膜通量(n = 6). ( p < 0.05; p < 0.01).
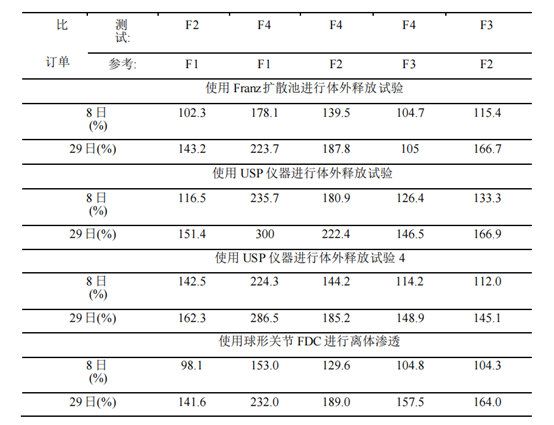
表3。用Wilcoxon秩和和曼-惠特尼(WilcoxonRank Sum/Mann-Whitney)比較3種體外釋放測試方法以及體外滲透法的區分能力
3.3.3 兔角膜的完整性
本研究旨在探討不同制造工藝對理化特性(體外藥物釋放)和體外經角膜通量的影響。在經角膜滲透性研究中,維持兔角膜上皮的完整性是至關重要的。因此,在實驗前,以及在藥物滲透研究后,上皮的完整性都被仔細檢查。將角膜保存在OptisolTM-GS中,溫度為4℃。在接收時(第0天)(圖6A)和儲存長達6天后(圖6B),使用he染色檢查兔角膜的完整性。角膜在至少6天內保持完整,但到第13天,上皮層不再連續,并且由于池丟失而變薄(圖6C)。因此,所有角膜均在3日內使用,以確保上皮的完整性。在pH值為7.4的含0.5%(w/v)SDS的人工淚液中進行半固體眼膏的體外藥物釋放試驗,以維持漏槽條件。然而,由于表面活性劑引起的嚴重去上皮,因此不能使用相同的介質進行離體滲透研究(圖6D)。惠普-βcd與其他賦形劑相比,具有良好的增溶性和兔眼耐受性(即使在濃度為12.5%的水溶液中也沒有毒性),是一種優良的眼科給藥賦形劑。我們使用了9%(w/v)的HP-β-CD作為滲透介質,并研究了不同的作用時間。正如預期的那樣,角膜在滲透介質中孵育(7小時)后保持完整(圖6E)。然而,當在球形Franz擴散池中放置類似時間(6.5 h)時,上皮層(圖6F)部分去上皮。通過將實驗時間縮短至4 h,可以避免這種損傷(圖6G)。由此推測,安裝到Franz擴散池后施加在角膜上的力可能對兔角膜的完整性有顯著影響。因此,在這種情況下,使用Franz擴散池進行的經角膜滲透研究的時間被限制在4小時。
氯替潑諾水溶性極低(約0.5μg/ml),在不添加增溶劑的情況下,受體艙內藥物濃度遠低于檢測限。因此,采用HP-β-CD作為增溶劑,在保持匯條件的同時增加藥物的溶解度。已有研究表明,環糊精本身不能增強藥物的經角膜滲透,但它們可以通過增加房水中游離藥物的量來增強局部藥物向眼內的遞送。在離體經角膜過程中,藥物分子必須通過5個不同的角膜層。就藥物滲透而言,最重要的角膜層是最外層的上皮層和最內層的基質層。其他層相對較薄,對藥物的滲透沒有明顯的阻力。對于親水分子來說,滲透到上皮層是限速步驟。而對于親脂性藥物分子,進入角膜基質層是限速步驟。氯替潑諾具有足夠的親脂性(logK為3.0),因此滲透到基質層是限速步驟。

圖 6。兔角膜的組織學照片:A)OptisolTM-GS儲存在第0天 4℃;B)OptisolTM-GS在第6天儲存于4℃中;C)在第13天儲存在OptisolTM-GS中(4℃);D)在含有0.5%(w/v)SDS的pH值為7.4的人工淚液中在34℃孵育4小時;E)在含有9%(w/v)HP-β-CD的pH 7.4人工淚液中,34℃孵育7小時;F)用于經角膜滲透性研究(持續 6.5 小時);和 G)用于經角膜滲透研究(持續4小時)。代表上皮層側(兔角膜外側)。
3.4 眼膏釋放藥物的離體相關性
為了更好地了解眼膏的理化屬性對體外藥物流量的影響,我們使用對數模型來研究流變學參數(CM和K值)與體外藥物流量之間可能的相關性。此外,使用線性模型來了解體外藥物釋放速率與體外經角膜藥物流量之間的相關性。我們觀察到所有四種軟膏配方的流變學參數(CM和K值)與經角膜藥物通量均有很強的對數相關性(圖7A)。當比較體外藥物釋放譜和體外經角膜滲透譜時(圖8),藥物滲透速率比使用不同釋放測試方法獲得的體外藥物釋放速率要慢得多。然而,四種制劑的體外釋放的等級順序與其滲透速率是相同的。繪制四種軟膏制劑的體外釋放率與體外釋放通量的關系圖,三種釋放測試方法均得到一條直線(R2> 0.98),表明四種Q1/Q2等效軟膏制劑的體外-體外線性相關良好(圖7B)。
使用不同的混合方法和賦形劑來源來制備四種Q1/Q2制劑。根據我們之前的研究,影響流變特性的主要有兩大制造因素:1)熱熔或非熱熔;以及2)白色的礦脂源。與使用非熱熔法(即簡單混合)制備的制劑相比,使用熱熔法制備的制劑顯示出更高的流變性質。熱熔法可使白色凡士林和礦物油緊密混合,因此,與簡單混合法相比,使用熱熔法制備的藥膏基質更致密。我們之前的研究表明,來自Fisher?的白色礦脂比來自Fougera?的礦脂具有更高的流變特性。因此,F1顯示出最高的流變學參數(交叉模量(CM)和K值),因為這一配方是用來自Fisher?的白色礦脂使用熱熔法制備的。目前的研究表明,兩種軟膏的體外藥物釋放和體外藥物流量是相反的與流變學參數相(圖7A)。流變學參數(CM和K值)越高,體外藥物釋放和體外通量越低。CM和K值是用來表征軟膏配方的兩個不同的流變學參數。CM表征了軟膏從固體狀態轉變為液體狀態時施加在軟膏上的振蕩應力。CM值越高,在應力作用下從固態向液態轉變的難度越大。K值表示在剪切速率為1 s-1的情況下,軟膏基底的表觀粘度。雖然在體外和離體藥物通量實驗中,軟膏樣品沒有受到任何應力,但軟膏的體外藥物釋放速率或離體藥物通量取決于其表觀黏度。這可以解釋為什么與CM 比,K值與體外藥物釋放率和體外藥物通量顯示出更高程度的相關性。
在三種體外釋放測試方法中,Franz擴散池法對所有四種劑型的釋放率最高(圖8)。這可以歸因于Franz擴散池法在供體室中添加了250μl的釋放介質(模擬淚液),有利于藥物的釋放。盡管釋藥速率存在差異,但對于4種Q1/Q2等效軟膏,3種釋藥方法的釋藥動力學和釋藥等級均相同。
為了更好地理解制備工藝對眼膏的離體經角膜滲透性的影響,我們使用線性回歸曲線的截距確定了四種劑型的延遲時間(圖5A)。F1、F2、F3和F4的滯后時間分別為(19.4±21.9)、(15.2±11.0)、(48.3±21.9)和(33.2±14.2)分鐘。熱熔法制備的制劑(F1 和F2)的滯后時間顯著短于非熱熔法制備的制劑(F3和F4)(p < 0.05)。這可能是由于這些制劑的密度較高而導致更快的傳熱和溫度平衡,從而允許藥物在初始時間點釋放。然而,一旦使用簡單混合制備的制劑達到熱平衡,由于這些軟膏的粘度較低,藥物釋放得更快。與使用來自Fisher?的白色礦脂制備的制劑相比,使用來自Fougera?的白色礦脂制備的制劑顯示出略短的延遲時間(即F1 vs. F2;F3 vs. F4)。這可能是由于白色的粘度較低的Fougera?石油脂。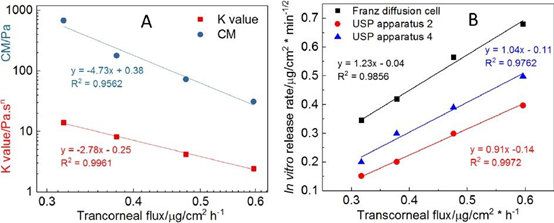
圖7。A)關鍵參數與經角膜通量之間的線性相關(對數模式);B)體外釋放率與體外經角膜通量之間的線性相關。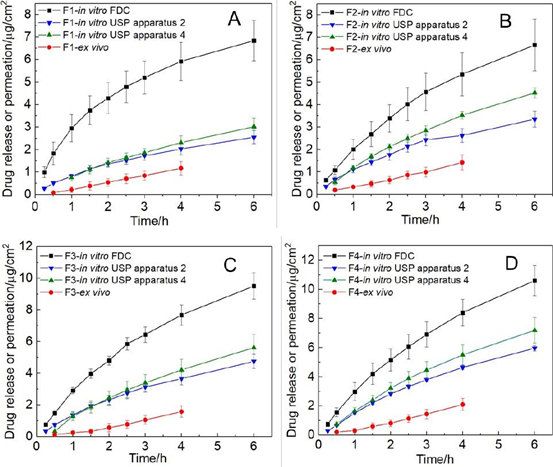
圖8。四種Q1/Q2等效半固體眼膏的體外藥物釋放和體外經角膜滲透特征:A)劑型1;B)劑型2;C)劑型3;D)劑型4。(FDC: Franz擴散池法;USP2法:USP2 +浸沒池法;USP4法;USP4采用半固體適配器法;離體:使用球形關節Franz擴散池的離體經角膜滲透)
本研究進一步證實了流變學參數(交叉模量和K值)作為表征半固體軟膏配方的基準的效用。此外,這些流變學參數也可用于表征其他半固體配方,如凝膠和乳膏。流變學參數與體外和體外藥物釋放量之間有很強的相關性。因此,流變學參數可用于預測體外藥物釋放和體外藥物滲透。這種相關性在以前的研究中尚未見報道。鑒于眼睛的特殊解剖結構,體內藥物釋放數據很難獲得,并且會受到撕裂和非生產性吸收等理化因素的影響。因此,體外-體內相關性(IVIVCs)的開發對眼科制劑具有挑戰性。因此,體外研究可能是比較眼用制劑包括生產差異的Q1/Q2等效制劑的一個很好的選擇。離體相關性可能提示可能存在IVIVC。軟膏制劑的體外藥物釋放是擴散控制的,因為它們的體外藥物釋放特征遵循Higuchi釋放動力學的所有三種釋放測試方法。在模型擬合過程中采用不同的時間范圍,眼膏的釋放動力學可能會發生變化,在選擇合適的時間范圍時應注意。在眼膏產品的研制過程中,應仔細檢查角膜上皮的完整性,以避免任何可能的誤差。
本項目的資金由美國食品藥品監督管理局撥款(1U01FD005177-01)提供。本文中表達的觀點不反映美國食品和藥物管理局或美國衛生與公眾服務部的官方政策;文中提及的任何商品名稱、商業做法或組織也不意味著獲得了美國政府的支持。
略 如需原文,請聯系小編(15012941165)