時間:

翻譯:華溶應用中心
審核:工業藥劑發燒友
最近的趨勢表明,與體內行為相關的溶出方法的描述的激增,包括諸如生物相關生物預測和臨床相關的術語。這些術語在文獻中經常互換使用,并且不一致。為了使行業與監管機構在標準術語上保持一致,以促進科學協作并促進一致的監管提交。本文的目的有兩個方面:第一,提出術語的一致性,第二,描述每種類型的方法在藥品開發和質量控制中的功能和適用性,包括潛在的好處和局限性
二、歷史觀點和近代演變的驅動力
速釋產品(IR)的質量控制(QC)溶出度試驗的目的和期望以及溶出度數據評估的相關標準(如規范)都在不斷完善。人們普遍認為溶出度是唯一能監測體外藥物釋放速度和程度的批量釋放試驗,該試驗常被用作替代方法,以確保體內性能的一致性。歷史上,開發質量控制溶出度試驗的重點是獲得可接受的變異性(ICH Q2(R1)指南),同時在合理的時間內實現對工藝參數變化的區分性。基本假設是,如果藥物批次在選定的溶出度測試中顯示出“相同”,它們將與關鍵臨床研究中使用的批次相比的體內性能相似,從而保持安全性和有效性的聯系。溶解曲線無論是在擬定的QC方法中獲得的,還是在SUPAC要求的多介質溶出中獲得的,都被用于評估開發中的產品一致性或證明批準后變更的合理性。
20世紀70年代,隨著標準化(USP裝置1和2)試驗的發展,以及1997年美國食品藥品監督管理局(FDA)采用溶出度指南,溶出度試驗首次得到廣泛應用。在此期間,選擇具有假定體內相關性的測試是相當簡單的,因為大多數正在開發的分子具有足夠的溶解度(即,生物藥劑學分類系統 (BCS) 1和3),并且使用相對簡單的常規片劑/膠囊制劑。簡單的生理相關pH值的水溶液緩沖液,如pH為1.2 (0.1N HCI)的鹽酸或pH為6.8的磷酸鹽緩沖液,通常是合適的測試介質,并獲得了一定程度的生物相關性。
在過去的二十年中,水溶性差的候選藥物數量顯著增加,大多數新的藥物開發候選藥物屬于BCS II類。雖然這些新的原料藥極大地增強了工業界尋找新的分子疾病靶標的能力,但它們也給處方和工藝開發帶來重大挑戰。這些挑戰在一定程度上使得配方、制造和給藥技術方面取得重大進步,以滿足速釋和緩釋的需求。無定形固體分散體、基于脂質的配方和顆粒工程方法通常用于遞送難溶性化合物。制藥工業中的這種技術進步對傳統溶出試驗的生物活性提出了重大挑戰,這將在本文件后面討論,并且需要在溶解領域取得進展,以提供額外的工具來預測產品性能(例如,開發與生物相關的溶解方法)。
另一個驅動力來自溶出開發領域。與了解分子和細胞水平的藥物性能相似,近年來大量的科學出版物證明了對預測體內藥物釋放和吸收及其與體外試驗的相關性的強烈興趣。這種興趣激發了在開發模擬人體胃腸道 (GI) 的新溶出介質和設備方面的創新,進一步了解溶出機制,將溶出數據整合到建模和模擬中,建立體外測試和體內性能的相關性、并結合溶出和其他分析技術的創新。在產品開發的各個階段使用多種溶出技術或多種溶出試驗,結合計算機建模以促進制劑選擇,已成為制藥工業中的常見做法。
此外,監管環境的變化也是推進溶出方法發展的的新動力。質量源于設計(QbD)的出現再次將重點放在將質量測試與產品性能聯系起來。因此,ICH Q8“行業、藥品開發指南”指出,實現所需的安全性和有效性是藥品質量的關鍵要素。因此,FDA和行業的一些介紹強調了在QC溶出試驗中建立“臨床相關性”的重要性,并提出了實現這一目標的一些方法。在QbD的概念內,在適當的情況下,可以使用臨床相關溶出度方法和規范性論證,將溶出度試驗所檢測的產品的可接受變異性與臨床相關性聯系起來。
三、不同溶出方法的定義
許多不同的溶出術語似乎可以互換使用,同時對不同的,或是模棱兩可的解釋持開放態度。為了盡量減少這種混淆,我們提出了一組新的定義:
1) QC溶出法;
2) 生物相關溶出方法
3) 臨床相關溶出方法。
QC溶出法
QC溶出方法的目的是檢測常規產品制造期間的變化和/或產品儲存期間可能對產品質量產生負面影響的變化。根據產品,這些變化可能與API、原材料或其他特定于制造工藝的關鍵屬性相關。例如,QC溶出方法應能夠識別已經過粒化或過壓的產品,或其中API的關鍵屬性(例如顆粒形態)或關鍵賦形劑(例如表面活性劑、制粒助劑、崩解劑、潤滑劑等)發生有利變化的產品,如SUPAC指南(1995) 中所定義。此外,QC方法需要穩健且簡單,使得其可以在典型QC環境中運行。因此,對于大多數IR和MR藥品,在整個產品開發過程中建立的條件下,用常規USP裝置1或2進行QC溶出。這些條件規定了溶解介質的pH、合成表面活性劑的水平 (如果需要)、溫度、介質攪拌或確保可靠數據所需的任何額外關鍵步驟。
QC溶出方法的一個關鍵因素是驗證該方法的有效區分力,如下所述。
生物相關溶出法
生物相關溶出方法的目的是試圖模擬藥物在胃腸道內將經歷的不同生理環境,具有指導制劑選擇和優化的總體目標,盡管這個方法不一定能推斷和預測臨床結果。這種方法在模擬不同體內環境(例如,胃、腸、結腸) ,或模擬食物對它的影響 (即,進食與禁食狀態)它們還有助于模擬質子泵抑制劑 PPI) 或胃酸缺乏患者的劑量效應,或藥物沉淀效應。生物相關溶出方法通常使用非標準實驗條件和/或設備,諸如生理相關介質 (例如,SGF、FaSSif、FeSSiF等) 、非下沉條件、雙相介質 (即,包括不混溶層,如辛醇以模擬滲透性)和多個隔室設備,或者它們模擬溶出和藥物吸收的組合。術語“生物相關”和“生物重復”溶出方法經常互換使用。如上所述,生物相關方法可能能夠預測體內實驗的結果,也可能不能預測體內實驗的結果
臨床相關溶出方法
將通過特定方法獲得的體外溶出數據與體內PK性能數據鏈接,建立體內外相關性(IVIVC或IVIVR),來建立臨床相關溶出方法。隨著體外-體內-相關性的建立,臨床相關溶出方法成為體內藥物釋放的預測。通常情況下,不可能建立完整的PK相關性;然而,該方法可用于通過經證實的藥代動力學安全空間確保一致的臨床性能。本節前面討論的QC和生物相關溶出方法都可能具有臨床相關性,只要它們能夠證明IVIVC/R的某些元素。
應當注意的是,這些不同的定義并不相互排斥。如圖1所示,三種方法都可以單獨確認或預測藥物的體內性能,并且它們甚至可以融合成一種具有生物活性的方法。另一方面,可以設想QC方法具有臨床相關性,但是開發中使用的生物相關方法可能不適合作為QC方法實施,因為該方法缺乏穩健性或不滿足局部和全局性(即,在60分鐘內完全釋放)。
這些術語之間的相互關系如圖1所示。
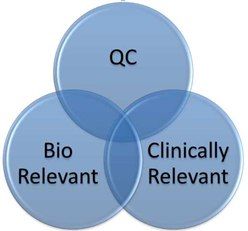
QC、生物相關和臨床相關溶出方法可以是三種不同的方法,用于不同的目的,如圖1中大部分不重疊部分所示。傳統意義上,QC方法將用于臨床批次放行和注冊穩定性測試的后期開發。產品經批準后,將QC溶出方法用于產品放行,作為確認產品一致性的措施。可以使用傳統溶出設備的生物相關方法,替代生理相關溶出介質,可用于早期制劑開發。多種pHs中的溶出度也可視為生物相關溶出度測試的早期版本,目前用于評估SUPAC和同等國際框架內的配方和工藝變化。在QbD背景下引入了臨床相關溶出方法的概念,并建議進一步了解工藝和PK參數的配方變化,最終確保僅“良好"產品被釋放,不可接受的產品被拒絕。然而,我們可以設想這三種方法都有一定程度的重疊,甚至完全重疊。在圖1中心所示的假設情況下,單一方法條件可滿足生物相關方法 (即,SGF作為溶出介質) 、QC方法 (即,USP 2,50 rpm,全球可接受的穩健方法)和臨床相關方法 (即,該方法可確認或預測人體PK) 的要求。
四、質量控制 (QC) 溶出試驗的演變作用
直到今天,溶出度測試仍然是制藥工業中一項重要的質量控制測試,用于批放行和穩定性監測。將溶出度測試用作質量控制工具是常見的做法,盡管存在一些微小差異但全球監管機構對該測試的要求達成了普遍共識。這可能是由于測試設備是標準化的而實驗方法是有限的,并且包含在指導中,指導是良好對齊的。大多數質量控制溶出方法使用通用的標準測試程序,例如USP1或2號裝置,500至900 mL的水緩沖液作為介質,具有足夠的沉降條件,裝置2的轉速為50-75轉/分,裝置1的轉速為50-75轉/分。然而,近年來,這種傳統QC角色增加了新的挑戰。最顯著的變化與使用溶出度作為QbD工具以及對臨床相關溶出度方法的期望有關。
產品開發中的溶出度測試
許多藥品制造商已將增強的產品和工藝理解整合到其開發戰略中。因此,使用各種溶出方法(例如,生物相關和QC方法)來了解關鍵工藝參數對藥物釋放程度和速率的影響。在開發的早期階段,生物相關溶出物(通常在內部開發并基于現有知識/最佳實踐)可用于指導配方和工藝選擇。根據API的理化性質和溶出參數的適當選擇,可以同時進行QC溶出試驗。在這些開發階段,評估QC溶出試驗對關鍵工藝和配制參數的敏感性。結果評估決定最終QC溶出方法。通常,在進入臨床階段3之前,產品開發集中于制劑和工藝參數的系統評估。這樣做的目的是持續生產與3期關鍵試驗中使用的批次相比具有同等安全性和有效性的產品。結果,在該開發階段使用的溶出度方法條件最終確定或幾乎最終確定為未來的監管QC方法。在工藝放大期間執行的實驗提供了評估溶解方法的質量的良好機會,例如穩健性和辨別力,其由方法對關鍵工藝參數和關鍵材料屬性的變化的敏感性定義
溶出試驗和臨床相關性
臨床相關溶出度規范(CRS)可能是增強產品理解的關鍵因素。在QbD推出后,對CRS的強調開始出現。為了證明所需工藝“設計空間”的合理性,證明充分的生物性能至關重要。在缺乏體內研究的情況下,溶出度是評估充分生物性能的唯一分析工具。然而,存在這樣的擔憂,即溶出試驗可能沒有足夠的靈敏度來識別工藝的變化,特別是在所提議的工藝設計空間的邊緣處制造的變體,確實滿足期望的體內性能。溶出方法(QC或生物相關)可能過于區分,從而限制工藝設計空間,或者該方法可能不敏感,從而支持可能導致不符合質量的產品釋放的操作條件。為了解決溶解方法中的這種模糊性,提出了探索過程變量與生物性能之間的關系。通過建立這種關系,能夠區分在各種工藝條件下制造的產品的支持體外溶出方法具有臨床相關性。
幾位作者提出了定義溶出試驗和體內性能之間聯系的方法
臨床相關規范可通過傳統生物利用度(BA)研究確定,也可通過建模和模擬確定。體內或計算機PK研究的結果可以是雙重的: 如果所觀察到的制劑變體的體外溶出曲線的差異也導致體內性能的差異,則可以開發體外體內相關性/關系(VIVC/R);對于表現出不同體外性能的制劑變體,如果在臨床藥代動力學方面沒有差異,則通常是這種情況27,則可以定義“安全空間”,在該“安全空間”內確保生物等效性
可能并不總是需要進行體內研究,例如對于符合BCS 1或3標準的IR藥品。一般認為,任何符合生物等效豁免測試標準的產品在患者中都具有合適的性能。對于符合這些標準的產品,指南中已定義了臨床相關溶出方法和驗收標準,也可用于QC目的。FDA關于BCS1類和3類產品溶出度測試的指南草案旨在將BCS生物豁免標準與QC放行測試聯系起來。
了解標準QC溶出方法的限制條件
大多數情況下,QC溶解依賴于標準溶解裝置,通常使用緩沖液作為介質,以及標準介質體積。這些參數引起可以限制QC方法的生物再灌注能力的基本約束,并且通常與介質的組成、模擬GI道的多個隔室的總體困難、不能解釋滲透性和溶解裝置的流體動力學有關。理解這些約束可以引導研究人員根據產品特性選擇合適的方法。
歷史上,質量控制實驗室中最常用的介質是pH 1.2、4.5或6.8的水或緩沖液,無論是否含有表面活性劑來模擬胃液 (SGF,pH 1.2)和腸液(SIF,pH 6.8)。然而,這些常見的培養基在組成上不類似于生物胃或腸液,顯示了緩沖液類型、離子強度和酶或表面活性劑(例如膽汁鹽)的存在/不存在的差異。使用USP 1或2的QC溶出試驗可以僅模擬一種胃腸道環境,例如胃或腸的一個部分。在人體中,藥品在通過胃腸道時經歷各種pH環境。
溶解度和滲透性通常在小腸內協同作用。對于高滲透性化合物,藥物可以從該動態體內系統快速吸收和除去,促進進一步溶出。相反,標準溶解測試是一個靜態系統,盡管已經有人試圖改變介質的pH作為時間的函數,甚至引入溶解-滲透系統。對于具有低溶解度和高滲透性的BCS2化合物,在標準溶出度儀中的溶出度可顯著低估體內溶出度,其中藥物可被吸收并從腸腔室中去除。美國藥典裝置4開環設置允許運行pH梯度系統來模擬人類胃腸道。與裝置1和2相比,其它USP裝置在使用多個介質或改變攪動方面也提供
五、溶出度測試超出傳統QC
溶出度試驗已超出傳統標準USP類型的方法。除了相對標準的QC溶出方法之外當今制藥工業中使用的溶出試驗包括各種不同的分析原理、儀器、介質以及與其他技術的組合。這是一個歡迎新想法或方法的開放領域。
生物相關溶出方法及其在早期開發中的應用
在生物相關溶出發育領域,已經并將繼續進行大量的工作,以試圖獲得對主要胃腸道狀況的更全面的模擬。
最常用于模擬腸道內不同區域的培養基已在文獻中詳細描述。pH、滲透壓摩爾濃度、表面張力和緩沖能力等介質性能已在許多不同產品上得到廣泛研究。除介質組成外,流體力學在建立IVIVC中發揮著關鍵作用。因此,一些生物相關溶出方法采用替代裝置,以獲得不能使用標準USP裝置1和2實現的流體動力學(參見理解標準QC溶出方法的限制)。通常使用雙相和多室溶解。在USP裝置2溶出系統中使用生物相關培養基也是常見的。
使用生物相關溶出物的最重要和廣泛采用的應用之一是在早期臨床開發階段,以實現“臨床使能制劑”的評估。術語“臨床使能制劑”用于增強藥品,其通過各種增溶制劑策略解決藥物的常見的次優生物藥劑學特性。這些制劑的實例是無定形固體分散體(ASD)片劑、軟凝膠膠囊(膠囊中的脂質)或具有無定形原料藥的常規制劑、高溶解度亞穩態多晶型物、無水物、溶劑化物、高可溶性鹽形式或共晶體。盡管這種制劑通常用于人類的早期臨床開發(階段1/2a),但是藥品的增強的生物利用度和在寬劑量范圍內的改進的暴露已經成為將這些生物增強制劑向前推進到后期臨床開發和商業化的驅動力。因此,基于生理學的溶出試驗,例如人胃腸道中的生物相關溶出模擬藥物釋放,可用于評估生物藥物風險,并區分不同類型的使能技術/制劑,以便建立有助于制劑選擇的等級順序
在缺乏足夠的體內數據的情況下,溶解方法通常基于先前的知識和成功應用的條件,以支持過去的類似產品開發工作。因此,使用非標準溶出方法來評價臨床使能制劑的關鍵特性,并且方法條件可以與用于QC方法的那些傳統條件非常不同。例如,經常采用非下沉條件。戈登阿米頓和他的同事最近提倡使用一種微型胃腸模擬器來改變培養基/pH(pH1.2模擬胃液/pH 6.5模擬腸液)來模擬BCS2b類藥物的體內溶出曲線49來自羅氏的一個研究小組主張以96-well的形式使用微型化的固有溶解工具,據聲稱該工具在適當的溶解介質的篩查中是有用的工具,并且表征發現/早期發育化合物的腸釋放特征50。
在產品開發的早期階段,當臨床數據有限時,動物數據、由建模不同胃腸道區域的方法產生的生物相關溶出度數據、或進食狀態與禁食狀態的方法產生的生物相關溶出度數據、以及在計算機模擬中經常用于通知制劑篩查或早期臨床開發。隨著開發進程,有大量API和配方組成變量需要評估。與標準QC方法相比,生物相關溶出度可對這些變量提供更適當的區分。此外,生物相關溶出度的結果被越來越多地用作基于生理學的藥代動力學建模工具,例如GastroPlus、SymCyp等。然后可以將建模和早期臨床數據一起用于預測體內產品性能。因此,生物相關溶解是配方和工藝開發范式中的重要工具。
生物相關質量控制方法的局限性
雖然可能希望QC溶出方法具有一定程度的生物可預測性,但是使用生物相關溶出進行質量控制通常是不合適的。一個原因是兩種方法的目的不同。在早期開發中,有大量API和配方組成變量需要評估,例如API屬性、輔料種類、用量、工藝路線。與QC溶出相比,生物相關溶出在區分這些變量方面具有顯著優勢。相反,在階段3及以后,制劑組成和所有這些變量基本上是固定的。QC方法的重點是要具有足夠的能力 (敏感),以確保制造過程在歷史上產生可接受產品的既定條件下運行。因此,對于工藝和制造變更,與生物相關溶出度相比,QC溶出度更合適,盡管生物相關溶出度方法可能已成功用于內部評價以指導制劑或工藝變更在產品批準之前或之后
對生物相關溶出方法的另一個限制是它們通常成本高、復雜、耗時或勞動密集、難以轉移或操作并且缺乏穩定性(例如對測試條件過于敏感)。這些特性通常被認為有足夠的問題,以排除常規批放行的生物相關方法的使用,特別是因為它可能導致虛假的超出規格(OOS)結果,這可能直接歸因于非穩定方法,而不是產品性能。此外,溶出方法的典型實踐是包括下沉條件,并且在IR產品的Q時間點顯示>80%的藥物釋放。這些要求對于確保體外一致性至關重要,但可能對體內可預測性產生不利影響。在一些情況下,生物相關方法應當能夠為多種制劑提供等級順序,例如比較結晶片劑制劑和無定形分散制劑,但是可能不能在合理時間(例如30分鐘)溶解>80%的藥物。這種不能限制此類方法用于QC目的。
由于上述原因,許多生物相關方法主要用于制藥工業的開發目的。盡管正在努力擬合生物相關方法和QC方法之間的差距,但很可能這兩種方法將繼續在產品開發和生命周期中發揮獨立但重要的作用,在開發和QC方法的常規制造過程中,主要關注生物相關方法。
臨床相關溶出度:將體外溶出度數據與藥物產品的體內性能聯系起來
當前QC溶出方法的主要重點是通過增強產品理解來實現后期產品開發,并在產品獲得批準后用作商業產品放行的質量控制方法。如果QC方法具有臨床相關性,則這是理想的。如上所述,通過在臨床PK研究中評估制劑變量,將溶出方法和結果與產品安全性和有效性聯系起來,可以實現臨床相關性。盡管希望完全了解關鍵質量屬性對人類產品性能的影響,以便以這種方式更好地開發控制方法,但制藥行業面臨的一個障礙是,在大量制劑和工藝變體上收集臨床數據是不切實際的(特別是,引入必要的制劑/工藝變異性以評估體內影響)。由于所需的資源,僅進行少數臨床研究以支持典型藥物開發周期中的制劑和工藝開發,并且不總是容易獲得相關臨床數據來指導臨床相關規范的設置。
BCS分類系統可幫助開發臨床相關溶出物。對于BCS1和BCS3化合物,在無實際體內數據的情況下,將80%的Q15分鐘 (BCS3)和30分鐘(BCS1)溶于500 ml0.01NHCI中,并輕輕攪拌,應視為具有臨床相關性。對于BCS 2和4化合物,建立溶出度方法的臨床相關性將需要將體外溶出度數據與體內PK數據聯系起來,這可能由于上述限制而受到挑戰
庫克提出了克服這一障礙的一種方法。他建議利用來自人類早期臨床研究(1/2a期)的信息,該信息可以使用液體和固體口服劑型,并且將來自多個早期臨床研究的輸出與基于生理學的吸收/藥代動力學模型整合以獲得體內溶出曲線。然后可以使用所有可用的體內信息開發體外溶出方法。本文作者提出的另一種方法是整合體外溶出度數據。當體外溶出方法處于最終開發階段時,使用1/2a期臨床保留樣品,以評價最終溶出方法與產品在人體中的性能之間的關系(涵蓋1-3期)。該方法還可用于比較不同的溶解條件,以選擇最合適的溶解方法進行質量控制。使用PBPK建模和模擬工具,例如GastroPlus,也有助于從機械上了解體內制劑性能的重要因素,然后可用于指導體外溶出試驗的開發。使用從開發早期使用的任何生物相關溶出方法收集的信息來指導后期QC方法的開發也是有益的。這可能將QC方法與早期臨床研究數據聯系起來,并有助于評估QC方法的鑒別能力。這種QC方法可以進一步開發,附加的人體PK數據變得具有臨床相關性。這些QC方法可能適于區分影響體內性能的關鍵材料屬性和工藝參數的變化,同時還保持質量控制和穩定性測試的穩健性
還應當認識到,作為監管質量控制工具的溶出度測試的使用,例如在臨床供應品的釋放中,可能在開發的早期階段是不合適的,因為過程和制劑可能仍然改變,因此監測產品質量的方法似乎是足夠的。在開發出制劑和溶出度試驗,理解其關鍵屬性,建立浴出度試驗的臨床相關性之前,其他技術(如崩解)可能是足夠的和適當的。
六、行業和監管機構建議
除了如上所述由制藥工業驅動的溶出開發的進步之外,許多與溶出相關的主題仍有待進一步探索。其中一個主題是如何在制藥行業和監管機構之間明確溝通溶出度測試的不同作用,為未來發展方向找到共同點。本文為智商成員提供了一個論壇,以描述他們對不同類型的溶解方法的看法,并激發更多的討論。調整行業和監管機構的建議如下:
增強生物相關溶解模型
生物相關溶解方法是產品開發的主要推動因素。它們經常在開發中用作體內制劑篩查的替代物,并且它們通常能夠連接體外和體內產品性能。然而,由于上文“用于QC目的的生物相關方法的限制”一節所述的原因,生物相關溶出工具通常遠不足以滿足制藥工業作為穩健的常規質量控制工具的實際需求。為了擴大用于QC目的的生物相關方法的效用,需要行業、學術界、溶解儀器公司和監管機構之間的強大合作,以開發下一代生物相關溶解模型。制藥行業應繼續在溶出模型和新儀器的開發中發揮積極作用,以彌補學術和工業應用之間的差距。
建立溶出方法的臨床相關性
盡管制藥行業歡迎臨床相關溶出度規范的概念,但符合全球監管預期的實用成功策略仍在不斷發展。制藥行業對制定臨床相關規范的實用方法非常感興趣,并且正在為新產品開發投入大量內部資源。將臨床性能與體外溶出試驗聯系起來通常需要整合臨床和CMC開發。根據臨床相關溶出度概念,某些監管指導文件(如SUPAC指南)可能需要重新檢查,以與當前思維一致。
監管機構與制藥行業或制藥公司之間的公開討論和知識共享是實現這一目標的一個非常重要的步驟。IQ協會成員公司已在一份出版物中匯編了我們對這一主題的看法,該出版物可作為此類討論的基礎。
七、結論
本文總結了由各制藥公司組成的IQ協會成員對溶出試驗在早期配方和工藝開發以及QC中的不同作用的看法。一般認為溶出試驗是藥物開發過程的組成部分。本文提供了生物相關、臨床相關和質量控制溶出度方法的定義,并探討了它們之間的相互關系。設計質量控制溶解方法以檢測在常規產品制造期間的變化和在可能負面影響產品性能的產品儲存期間的變化。質量控制方法的主要目的是確認商業產品在放行時和在產品保質期內的批次間一致性。生物相關溶出力試圖通過使用生理相關介質以及標準和非標準設備和條件來模擬藥物將在胃腸道內經歷的不同生理環境。生物相關溶出度的關鍵目的是在缺乏臨床PK數據的情況下指導制劑開發。通過將體外溶出度數據與PK性能聯系起來建立體外體內關系(IVIVC、IVIVR或PK“安全空間”),為任何類型的方法建立臨床相關性。當用作難溶藥物的質量控制方法時,臨床相關溶出度提供了一種增強的方法以直接確認每個批次符合開發期間確定的所需生物性能標準。
IQ協會建議,對于常規批次放行和穩定性研究,良好開發的質量控制方法是可接受應接受與生物性能相關的臨床相關方法,作為生物等效豁免和其他批準后變更的支持。
八、文獻